1. Establécese las exigencias para la autorización
de plaguicidas.
TITULO I. DISPOSICIONES GENERALES
2. Definiciones y acrónimos
Para los efectos de esta Resolución se entenderá por:
a. Aditivo: Componente añadido distinto de la
sustancia activa y que no sean impurezas resultantes del
proceso de fabricación. Tiene por objeto mantener la
estabilidad y facilitar la manipulación de la sustancia
activa grado técnico, como activo técnico (TC) o
concentrado técnico(TK).
b. Autorización de Plaguicida: Resolución que aprueba
la fabricación, importación, distribución, exportación,
venta, tenencia o aplicación de un plaguicida, que surge
como resultado de la evaluación de un conjunto de
determinaciones experimentales pruebas documentadas
presentadas en apoyo de todas las afirmaciones relacionadas
con las características que demuestren que el plaguicida es
efectivo para el fin a que se destina y no entraña un
riesgo inaceptable para la salud humana, animal ni para el
medioambiente. Cada plaguicida estará identificado por un
número de registro del Servicio.
c. Autorización de Muestra de Plaguicida para
Experimentación: Resolución mediante la cual se aprueba
una cantidad limitada de un plaguicida, para efectuar
investigación exploratoria en escala reducida.
d. Coformulante: Cualquier sustancia, distinta de la
sustancia activa grado técnico, incorporada
intencionalmente a la formulación.
e. Equivalencia: Proceso para la determinación de la
similaridad de los perfiles de impurezas, toxicológicos
ecotoxicológicos, así como de las propiedades físicas y
químicas presentadas para sustancias activas grado técnico
supuestamente similares generados por distintos fabricantes,
para establecer si ellos presentan niveles similares de
riesgo.
e. bis. Especificación del Servicio: Aquella
especificación de parámetros de calidad tales como pureza
de la sustancia activa, contenido máximo de impureza
relevante u otro, que el Servicio establece para la
evaluación y autorización de un plaguicida por
equivalencia e identidad.
f. Formulación: Fabricación del producto formulado.
g. ELIMINADO.
h. Identidad: Proceso para la autorización de una
sustancia activa grado técnico y un producto formulado en
el cuál los antecedentes técnicos acreditan un perfil
único.
i. Impurezas relevantes: Son aquellos subproductos de
fabricación o almacenamiento del plaguicida, los cuales,
comparados con la sustancia activa, son toxicológicamente
significativos para la salud o el ambiente, son fitotóxicos
a las plantas tratadas, causan contaminación en cultivos
para consumo, afectan la estabilidad del plaguicida o
presentan cualquier otro efecto adverso.
j. Ingrediente Activo: Sustancia Activa.
k. Lote de fabricación: La cantidad definida de un
material producida en una sola operación.
l. Patrón de referencia o patrón: Aquella sustancia
activa grado técnico que luego de su evaluación,
determinación y autorización respectiva, se establece como
la referencia vigente para la autorización de un plaguicida
por equivalencia.
m. Plaguicida: Compuesto químico, orgánico o
inorgánico, o sustancia natural que se utilice para
combatir malezas, enfermedades o plagas potencialmente
capaces de causar perjuicios en organismos u objetos. Se
considerará como tal, el producto formulado y las
sustancias activas con las que se formulan, con aptitudes
insecticidas, reguladores de crecimiento de insectos,
agentes sofocantes, acaricidas, nematicidas, molusquicidas,
rodenticidas, lagomorficidas, fumigantes, fungicidas,
bactericidas, desinfectantes, viricidas, microbicidas,
preservantes de madera, alguicidas, herbicidas, defoliantes,
desecantes, fitorreguladores, coadyuvantes,
antitranspirantes, atrayentes, feromonas, aleloquímicos,
repelentes, recubrimientos protectores de cultivos,
inductores de resistencia y otros que se empleen en las
actividades agrícolas y forestales y en otros ámbitos en
los que este Servicio tenga competencia.
n. Plaguicida Natural: Son los plaguicidas basados en
sustancias naturales pudiendo utilizarse por sí solos o en
una formulación. Dentro de ellos podemos encontrar:
i. Plaguicidas biológicos, basados en agentes de
control biológico (microorganismos y
macroorganismos) nativos o exóticos, y basados en
microorganismos acompañados de sus toxinas y metabolitos
con acción plaguicida;
ii. Plaguicidas naturales químicos, basados en
extractos de origen vegetal, animal, mineral y extractos de
fermentación microbiológica por sí solos;
iii. Plaguicidas semioquímicos, basados en
feromonas que actúan entre miembros de una especie, y en
aleloquímicos tales como cairomonas, alomonas, sinomonas y
antimonas, que actúan entre miembros de diferentes
especies, que pueden actuar como atrayentes o repelentes,
las que pueden ser de origen natural o en algunos casos
sintetizadas.
n bis. Producción: Fabricación de
sustancias naturales o de productos formulados, cuando se
trate de plaguicidas naturales
ñ. Productor: Fabricante de sustancias naturales o de
productos formulados, cuando se trate de plaguicidas
naturales
o. Resumen Ejecutivo: Informe impreso o en formato
digital con una síntesis de la información requerida en
los Antecedentes del Titular, los Requisitos Técnicos para
la Evaluación de Plaguicidas y en los Documentos
solicitados en esta norma, correspondiente al plaguicida
objeto de la solicitud de autorización.
p. Sustancia Activa: Componente que confiere la acción
biológica esperada a un plaguicida, o modifica el efecto de
otro plaguicida.
q. Sustancia Activa Equivalente: Aquella que luego de
la evaluación efectuada por el Servicio, cumple con las
especificaciones de la Sustancia Activa Patrón.
r. Sustancia Activa Grado Técnico: Sustancia activa
tal cual se obtiene de la síntesis industrial; se compone
del ingrediente activo, subproductos relacionados e
impurezas, pudiendo contener pequeñas cantidades de
aditivos.
s. Sustancia Activa Nueva: Aquella entidad química
nueva que cumple con las condiciones sobre Ley de Propiedad
Industrial y goza de los beneficios que
ésta indica.
t. Sustancia natural: Son las sustancias
activas que pueden corresponder a:
i. extractos naturales de origen vegetal, animal,
mineral o extractos de fermentación microbiológica por sí
solos;
ii. aleloquímicos (cairomonas, alomonas, sinomonas o
antimonas), o feromonas (tales como feromonas de artrópodos
o feromonas de lepidópteros), los que pueden ser de origen
natural o en algunos casos sintetizados; o
iii. agentes de control biológico (microorganismos y
macroorganismos) nativos o exóticos, o microorganismos
acompañados de sus toxinas y metabolitos con acción
plaguicida.
Para los efectos de esta Resolución se
utilizarán los siguientes
acrónimos:
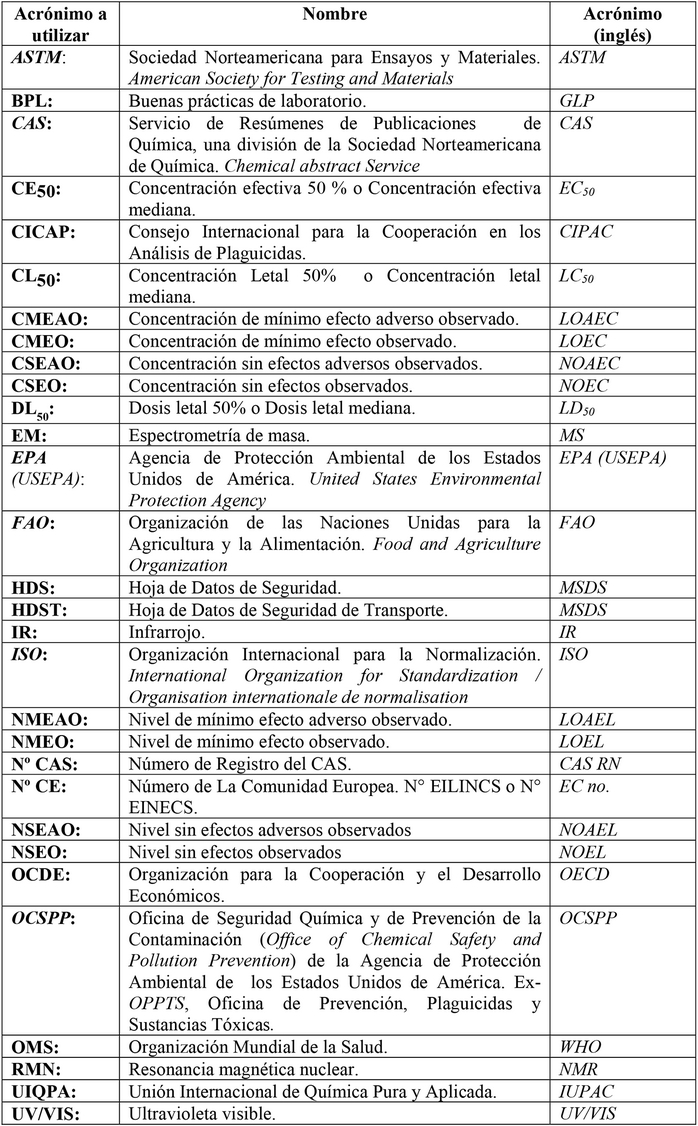
|
3. De la autorización y sus tipos
Sólo se podrá fabricar, importar, exportar,
distribuir, vender, tener o aplicar, plaguicidas de uso en
agricultura autorizados por el Servicio. La autorización no
constituye propiedad del plaguicida ni de la sustancia
activa que contiene.
La autorización se otorgará previa evaluación
favorable del Servicio, realizada en conformidad con lo
establecido en la presente Resolución, debiendo para ello,
haber demostrado que el plaguicida es efectivo para el fin a
que se destina y no entraña un riesgo inaceptable para la
salud humana, animal ni para el medioambiente.
Los tipos de autorización de plaguicidas, son los
siguientes:
a. Por identidad: para plaguicidas formulados,
sustancias activas nuevas, sustancias activas químicas
sintéticas que no tiene un patrón de referencia
determinado, los coadyuvantes o las sustancias naturales
(sustancias semioquímicas, sustancias naturales químicas y
sustancias biológicas).
b. Por equivalencia: para los plaguicidas formulados en
base a sustancias activas químicas sintéticas, para las
cuales exista una especificación del Servicio, quedando
excluidos de este tipo de autorización los plaguicidas
naturales (plaguicidas semioquímicos, plaguicidas naturales
químicos y plaguicidas biológicos).
c. Autorizaciones especiales: para
plaguicidas como sustancias activas grado técnico,
productos formulados, u otros, según corresponda; que el
Servicio determina de acuerdo a otros requisitos de
evaluación que no están contemplados en los numerales a y
b; o para usos especiales de acuerdo a disposiciones
especiales de la normativa, y otras leyes o reglamentos en
los que el Servicio tiene atribuciones, tales como:
i. Plaguicidas como sustancias activas grado técnico
idénticas, o como productos formulados; idénticos a otros
ya autorizados.
ii. Plaguicidas para uso en producción orgánica.
iii. Plaguicidas para uso en cultivos menores.
iv. Plaguicidas para solo exportación.
v. Feromonas de monitoreo.
vi. Muestras de plaguicidas para experimentación.
vii. Patrones analíticos.
viii. Plaguicidas para usos especiales.
ix. Plaguicidas que se han sometido al esquema de
reconocimiento del proceso de registro o autorización de
sustancias activas grado técnico de Estados Unidos de
América o la Unión Europea.
4. Requerimientos previos técnicos y administrativos para
la autorización de un plaguicida.
4.1. Solicitante o Titular.
La autorización deberá ser solicitada al Servicio por
una persona que tenga su domicilio en el país y deberá
presentar los siguientes antecedentes:
4.1.1. Nombre, RUT y Dirección.
4.1.2. Representante Legal, RUT, Dirección
(Deberá acreditar legalmente la representación) y Correo
electrónico.
4.1.3. Página web, si corresponde.
4.1.4. Antecedentes que demuestren que el
solicitante cuenta con asesoría de una persona con
conocimiento, formación o experiencia en lo que se
relacione con los plaguicidas. Esta persona deberá estar
designada por el representante legal, mediante declaración
jurada ante notario.
4.2. Condiciones de la documentación.
La información que se solicita, por esta Resolución y
según el caso, debe proporcionarse sólo si ella es
inherente al plaguicida en evaluación. La no presentación
de cualquier información, deberá estar acompañada de una
justificación técnica.
Toda la documentación que se adjunte como antecedente
para la autorización de un plaguicida, debe estar escrita
en idioma español, inglés o portugués, en este último
caso acompañado de su traducción al español. Con todo, es
responsabilidad del solicitante la veracidad de los
antecedentes que proporcione.
El Resumen ejecutivo debe estar en idioma español.
Los documentos que se acompañen a la solicitud de
autorización, deberán presentarse en original impreso,
debidamente foliado y una copia digital.
En el caso de haberse emitido en el
extranjero los siguientes documentos deberán cumplir con
las formalidades establecidas en la legislación vigente
para que tengan validez en el país:
a. Documentos emitidos por las autoridades competentes:
Certificados que demuestren la dirección del fabricante o
productor y que en dicha planta se fabrica la sustancia
activa grado técnico, se produce la sustancia natural o se
produce o fabrica el producto formulado.
b. Documentos emitidos por el productor o fabricante, o
un tercero por contrato en el extranjero: Certificados de
Composición cualicuantitativo, Certificado de
Fabricación/Formulación/Producción de la sustancia activa
grado técnico, sustancia natural o producto formulado,
Certificados de Producto Libre de organismos genéticamente
modificados (OGM) de la emitido por el productor de la
sustancia natural o producto formulado, Certificados de
Confirmación de Compatibilidad para Uso en Agricultura
Orgánica.
c. Documentos emitidos por la Cámara de Comercio del
país de origen: Certificados que demuestren la dirección
del fabricante o el productor y que en dicha planta se
fabrica la sustancia activa grado técnico, se produce la
sustancia natural o se produce o fabrica el producto
formulado.
En el caso de los Certificados de Composición
cualicuantitativo emitidos en el país, estos deberán ser
autorizados ante notario.
Todo documento, declaración, justificación técnica o
informe complementario a los antecedentes presentados al
momento de presentar solicitud de registro, deberá estar
respaldado con firma autorizada por el solicitante del
profesional del área correspondiente o facultado por el
solicitante para ese fin.
4.3. Estudios realizados para el respaldo del
expediente.
Cuando los usos del plaguicida se respalden con
estudios de eficacia, el solicitante de la autorización de
un plaguicida deberá previamente haber finalizado los
ensayos de verificación de eficacia preliminarmente
autorizados por el Servicio, de acuerdo con lo establecido
en la Resolución de este Servicio que establece los
requisitos para las muestras de plaguicidas de uso
experimental.
Cuando el uso a solicitar corresponda a una misma
combinación plaga y cultivo autorizada previamente para
otro plaguicida con igual concentración de sustancia activa
y misma formulación, sólo deberá acreditarse la
certificación de eficacia otorgada por estaciones
experimentales autorizadas por el Servicio.
Los informes de estudios realizados fuera del país,
deberán cumplir con las condiciones descritas en el numeral
4.2., y lo descrito en los requisitos técnicos respectivos.
Para el caso de estudios realizados con protocolos de otros
países, deberá adjuntarse el protocolo completo. Los
estudios hechos con protocolos propios del solicitante,
deberán venir acompañados de la metodología completa, y
la validación correspondiente del laboratorio.
4.4. Publicación de Extracto en el Diario Oficial.
El solicitante deberá publicar un extracto de la
solicitud de autorización de un plaguicida en el Diario
Oficial, previamente visado por el Servicio. La publicación
deberá realizarse los días primero o quince de cada mes, o
el primer día hábil siguiente, si aquellos fueren domingo
o feriado.
El extracto, deberá contener la individualización del
solicitante de la autorización; el nombre comercial del
plaguicida, aptitud, composición, tipo de formulación,
fabricante del producto formulado,
usos a que se destinará y clasificación toxicológica.
Cualquier interesado podrá presentar ante el Servicio
observaciones fundadas a la solicitud, las que deberán
presentarse por escrito, dentro del plazo de cuarenta y
cinco (45) días hábiles contados desde la fecha de la
publicación, las cuales serán analizadas por el Servicio
en el proceso de evaluación de la solicitud de
autorización del plaguicida.
4.5. Tarifas.
El solicitante de una autorización de un plaguicida
deberá pagar las tarifas establecidas en las distintas
etapas del proceso de autorización de un plaguicida.
4.6. Presentación de la Solicitud.
El solicitante deberá presentar, no antes del día 46
de publicado el extracto, el formulario de solicitud
establecido por el Servicio, formulario el cual contiene una
lista de verificación de toda la documentación requerida
para la evaluación y una declaración jurada simple; en
caso que transcurra más de un año desde la publicación
del extracto sin presentarse el formulario o la información
publicada en el extracto difiera de la del formulario,
deberá publicarse un nuevo extracto. La solicitud deberá
ser firmada por el representante legal, quien se hace
responsable que la información contenida en el expediente
se encuentra completa, de acuerdo a lo requerido en la
presente Resolución.
La solicitud se tendrá por presentada válidamente,
sólo desde el día de su presentación efectiva en los
términos del párrafo anterior y desde ese día se
iniciará su tramitación.
5. Documentación requerida posterior a la evaluación
técnica favorable.
5.1. Para la sustancia activa grado técnico se
requiere:
a. Dos ejemplares de la HDS según la Norma Chilena NCh2245
vigente si se importa o fabrica en el país, o según la
norma que corresponda al país de origen del plaguicida,
cuando no se cumpla lo anterior; uno en original impreso y
el otro en formato digital, para su inclusión en los
antecedentes de evaluación para la sustancia activa grado
técnico. Cuando la sustancia activa se importe o fabrique
para la formulación nacional, una vez verificada durante la
evaluación, la HDS según la Norma Chilena NCh2245 vigente,
deberán remitirse al Servicio los ejemplares en formato
impreso y digital ajustados a los términos de la
evaluación realizada, para la emisión de la resolución de
autorización correspondiente.
b. Proyecto de la etiqueta de transporte de la unidad
de embalaje de la sustancia activa grado técnico, uno en
original impreso y el otro en formato digital, para su
inclusión en los antecedentes de evaluación para la
sustancia activa grado técnico. Cuando la sustancia activa
se importe o fabrique para la formulación nacional, una vez
verificada durante la evaluación y aprobada la etiqueta,
deberán remitirse al Servicio los ejemplares de ésta en el
número que el Servicio determine, ajustados a los términos
de la evaluación realizada, para la emisión de la
resolución de autorización correspondiente.
5.2. Para el producto formulado se requiere:
a. Dos ejemplares de la HDS y según la Norma
Chilena NCh2245 vigente, uno en original impreso y el otro
en formato digital, para su inclusión en los antecedentes
de evaluación del producto. Una vez verificada durante la
evaluación, la HDS según la Norma Chilena NCh2245 vigente,
deberán remitirse al Servicio los ejemplares en formato
digital e impreso, ajustados a los términos de la
evaluación realizada, para la emisión de la resolución de
autorización correspondiente.
b. Proyecto de la etiqueta con que se expenderá en el
país el plaguicida cuya autorización se solicita. Deberá
enviarse al Servicio dos ejemplares del proyecto de
etiqueta, uno en original impreso y el otro en formato
digital, para su inclusión en los antecedentes de
evaluación del producto. Una vez aprobada la etiqueta,
deberán remitirse al Servicio los ejemplares de ésta en el
número que el Servicio determine en formato impreso y en
formato digital, ajustados a los términos de la evaluación
realizada, para la emisión de la resolución de
autorización correspondiente.
TITULO II. AUTORIZACION POR IDENTIDAD
6. Procedimiento para la evaluación y autorización por
Identidad.
El Servicio deberá pronunciarse sobre la autorización
de un plaguicida dentro del plazo de nueve meses, contados
desde que el Servicio cuente con la totalidad de la
información necesaria para la evaluación técnica (Etapa
II). Este plazo se suspenderá desde la fecha de la
solicitud de antecedentes adicionales por parte del Servicio
hasta la entrega de los antecedentes requeridos al
solicitante.
6.1. Documentación para la evaluación y autorización
por Identidad
El solicitante deberá proceder de acuerdo al numeral
4.6 y presentar la siguiente documentación para la
evaluación del plaguicida, la cual deberá encontrarse
ordenada de la siguiente manera:
a. En relación al solicitante y titular, según
corresponda, lo establecido en el numeral 4.1.
b. En relación a la Sustancia Activa, lo establecido
en el numeral 8.
c. En relación al Producto Formulado, lo establecido
en el numeral 9.
6.2. Verificación, evaluación y autorización por
Identidad.
6.2.1 Verificación documental (Etapa I).
El Servicio verificará que la documentación de
respaldo presentada corresponde a lo exigido en la presente
Resolución. Si el expediente cuenta con toda la
información, el Servicio informará al solicitante la
conformidad de la etapa de verificación documental. Si la
solicitud no reúne los requisitos señalados en la presente
resolución, el Servicio lo comunicará por escrito al
solicitante, quien tendrá un plazo de veinte (20) días
hábiles para completar la documentación faltante. En caso
de no dar respuesta o no complementar adecuadamente las
observaciones y no conformidades efectuadas por el Servicio,
se tendrá por desistida la solicitud y se procederá a la
devolución del expediente.
6.2.2. Verificación analítica.
En el caso que se presenten análisis de 5 lotes
efectuados sin BPL, el Servicio o un laboratorio autorizado
por éste, comprobará que el análisis de los 5 (cinco)
lotes de fabricación se haya confeccionado de acuerdo a
prácticas de laboratorios internacionalmente reconocidas
(FAO, AOAC, OCSPP, OCDE, otras), por lo cual se requerirán
elementos probatorios como cromatogramas, espectros, etc.,
acompañados con métodos analíticos validados tanto para
la sustancia activa como para las impurezas. Los límites
máximos de las impurezas relevantes tendrán como base los
valores establecidos internacionalmente por FAO, la Unión
Europea o entidades reconocidas internacionalmente.
En el caso de dudas sobre la calidad y/o autenticidad
de algunos de los ítems a evaluar, o para la verificación
de un lote que sea distinto a los contemplados en el
análisis de 5 lotes con BPL, el Servicio solicitará
muestras de los lotes analizados, patrones analíticos o
cualquier otro elemento, con el objeto de realizar, en
laboratorios del Servicio o autorizados, las determinaciones
analíticas que se consideren necesarias. Las
determinaciones serán de costo del solicitante, debiendo
proveer los patrones analíticos en cantidades suficientes e
ingresándolos de acuerdo a la Resolución de este Servicio
que establece normas para el ingreso de patrones analíticos
de plaguicidas de competencia del Servicio Agrícola y
Ganadero y a lo establecido en la normativa vigente.
6.2.3. Evaluación técnica (Etapa II) de la
información presentada.
Aprobada la verificación documental y la verificación
analítica en los casos que corresponda, el Servicio
procederá a la evaluación de la información presentada y
las observaciones detectadas, serán comunicadas por escrito
al solicitante, quien tendrá un plazo de treinta (30) días
hábiles para dar respuesta. En caso de no dar respuesta, se
aplicará lo dispuesto en el artículo 43 de la Ley Nº
19.880.
Para el caso de estudios adicionales del plaguicida
(sustancia activa o producto formulado), que el Servicio
determine que se deben realizar para resolver la solicitud,
éste otorgará el plazo correspondiente de acuerdo a lo
requerido por él o los estudios. En caso de no dar
respuesta dentro del plazo otorgado, se aplicará lo
dispuesto en el artículo 43 de la Ley Nº 19.880.
6.2.4. Revisión de la etiqueta (Etapa III) y
resolución de autorización.
Si los antecedentes cumplen con lo establecido en la
presente Resolución y demuestran que el plaguicida es
efectivo para el fin a que se destina y no entraña un
riesgo inaceptable para la salud humana, animal ni para el
medioambiente, se solicitará que en el plazo de diez (10)
días hábiles contados desde que se entiende notificado, se
envíe la documentación establecida en el numeral 5.
Una vez recepcionada y considerada conforme la
documentación solicitada, el Servicio emitirá la
resolución de autorización del producto formulado en base
a su sustancia activa grado técnico, y será notificada al
solicitante.
Cada plaguicida autorizado, será numerado
correlativamente, debiendo el número incluirse en la
etiqueta respectiva.
De no cumplirse con lo dispuesto en la presente
Resolución, el Servicio emitirá una resolución de
rechazo, la que se notificará al solicitante.
7. Vigencia de la autorización de identidad.
El plaguicida será autorizado por primera vez, para
las combinaciones específicas plaga-cultivo y bajo las
condiciones indicadas en ésta, con una vigencia de 10
años, los que podrán ser renovables, por igual período,
si cumple con las disposiciones establecidas del Servicio.
7 bis. Condiciones y requisitos para la
evaluación y autorización de plaguicidas naturales
(químicos naturales, semioquímicos y biológicos) y
coadyuvantes.
7 bis.1. Las condiciones y los requisitos para la
evaluación y autorización por identidad de plaguicidas
químicos naturales, semioquímicos y biológicos; y
coadyuvantes se regirán por las resoluciones específicas
dictadas por el Servicio y a través de las cuales se
establecen las condiciones y requisitos para evaluar tales
plaguicidas, de acuerdo al caso.
En los casos que los tipos de plaguicidas anteriores,
tanto sustancias activas grado técnico como productos
formulados, no posean condiciones o requisitos específicos,
se regirán por las disposiciones del Título I de
Autorización por Identidad y los requisitos indicados en
los numerales 4, 5, 8 y 9, en los que se adaptará la norma
a la naturaleza de los plaguicidas como sustancia activa
grado técnico y producto formulado, en base al principio de
aplicabilidad.
Para las evaluaciones favorables de plaguicidas
naturales y coadyuvantes, el Servicio emitirá la
resolución de autorización correspondiente, que será
notificada al solicitante. A cada producto formulado se le
asignará un número de autorización, que debe incluirse en
la etiqueta respectiva. Asimismo, a cada sustancia activa
grado técnico se le asignará un código correlativo de uso
y control interno.
8. Requisitos técnicos para la evaluación de sustancias
activas.
Se deberán presentar los siguientes antecedentes:
8.1. Identidad de la Sustancia Activa
8.1.1. Fabricante de la sustancia activa
8.1.1.1. Nombre.
8.1.1.2. Dirección de la planta. Se establece
la siguiente secuencia de criterios priorizados, en donde el
documento a presentar debe contener, al menos, lo siguiente:
i) indicar la dirección de la planta donde se fabrica
la sustancia activa grado técnico o se produce la sustancia
natural,
ii) indicación explícitamente que en dicha planta se
fabrica la sustancia activa grado técnico o se produce la
sustancia natural en cuestión, y
iii) este documento deberá presentarse con la
apostilla del país de dicha planta. La prioridad es la
siguiente:
1º Certificado emitido por la Autoridad Competente del
país de origen,
2º Certificado emitido por la Cámara de Comercio del
país de origen,
3º Certificado emitido por el fabricante. Cuando se
presente un documento prioridad 2 o 3, se deberá justificar
debidamente la no presentación del documento de mayor
prioridad.
8.1.2. Nombre común:
8.1.2.1. Aceptado por ISO.
8.1.2.2. Propuesto, por ISO.
8.1.3. Sinónimo (si tiene).
8.1.4. Nombre químico (aceptado o propuesto por
UIQPA, CAS).
8.1.5. Fórmula empírica, fórmula estructural
(incluyendo estereoquímica de isómeros activos si
corresponde) y masa molecular.
8.1.6. Nº CAS, Nº CE (para cada isómero o mezcla
de isómeros si corresponde) y CICAP.
8.1.7. Número de código experimental (cuando
proceda).
8.1.8. Grupo químico a que pertenece.
8.1.9. Método de fabricación de la sustancia
activa.
Esta información deberá venir respaldada por un
Certificado con el método de fabricación, incluyendo
procedimiento de síntesis, especificando las condiciones y
disolventes empleados de la sustancia activa, emitido por el
fabricante.
8.1.10. Grado de pureza (contenido mínimo de
sustancia activa en g/kg).
8.1.11. Isómeros.
a. Identificación. Nombre químico UIQPA y CAS;
nombre común, si existe; su fórmula empírica y
estructural; número CAS, CE y CICAP (Si existe), y masa
molecular.
b. Proporción en que se encuentran, y contenido
mínimo en g/kg, para los isómeros activos. Para el caso de
los isómeros inactivos señalar el contenido máximo.
8.1.12. Impurezas y subproductos, identificándolas
con su nombre químico UIQPA y CAS; nombre común, si
existe; su fórmula empírica y estructural; número CAS, CE
y CICAP (Si existe) y masa molecular.
a. De contenido mayor o igual a 1 g/kg, si no tienen
efectos adversos, indicar su contenido máximo en g/kg.
El límite máximo para las impurezas relevantes
también debe estar respaldado por datos analíticos de lote
de fabricación (mínimo cinco lotes típicos) y el
proponente debe establecer las bases estadísticas para los
límites de fabricación.
b. De cualquier contenido, para impurezas
relevantes (aclarar y especificar los efectos adversos
observados, por ejemplo, efectos toxicológicos,
ecotoxicológicos o medioambientales, o efectos sobre la
estabilidad de la sustancia activa).
8.1.13. Aditivos (ej.: estabilizantes).
a. Identificación, Nombre químico UIQPA y CAS; nombre
común, si existe; su fórmula empírica y estructural;
número CAS, CE y CICAP (Si existe), y masa molecular.
En caso que el aditivo sea una mezcla, señalar nombre
y Nº CAS y CE de cada componente. Indicar la función de
cada uno de los aditivos.
b. Contenido máximo en g/kg.
La información de los puntos 8.1.10-11-12-13, deberá
venir respaldada con certificado de composición
cualicuantitativo, emitido por el fabricante o productor, y
por el perfil analítico de lotes.
8.1.14. Perfil analítico de lotes.
El solicitante analizará muestras representativas de
la sustancia activa para determinar el contenido de
sustancia activa pura, isómeros inactivos, impurezas y
aditivos, según proceda, hechos por o para el fabricante o
productor. Los resultados analíticos comunicados deberán
recoger datos cuantitativos, en términos de g/kg de
contenido, de todos los componentes presentes en cantidades
iguales o superiores a 1 g/kg.
Típicamente la fracción no identificada y/o no contable
del TC o TK no debe exceder de 20 g/kg. Se determinará e
indicará el contenido real de los componentes que sean
peligrosos por sus propiedades toxicológicas,
ecotoxicológicas o medioambientales. Los datos facilitados
deberán recoger los resultados de los análisis de muestras
individuales y resumen de dichos datos, para mostrar el
contenido mínimo o máximo y el contenido normal de cada
uno de los componentes pertinentes, si procede.
En caso que una sustancia activa se produzca en
distintas plantas, estos datos deberán facilitarse para
cada planta.
Los estudios de los 5 lotes de fabricación que son
realizados después de entrar en vigencia esta normativa
requieren ser con BPL. En el caso que se presenten análisis
de 5 lotes efectuados sin BPL, estos deberán dar
cumplimiento a lo establecido en el numeral 6.2.2.
Las bases estadísticas para los límites de
fabricación deben explicarse (por ejemplo: nivel máximo
encontrado en la práctica; la media, más 3 veces la
desviación estándar de niveles encontrados en la
práctica; etc.).
Cuando corresponda, deberán analizarse muestras de
sustancia activa producidas en laboratorio o en sistemas de
producción piloto, si se ha utilizado ese material para
generar datos toxicológicos o ecotoxicológicos.
8.1.15. Países a los que se exportará,
cuando corresponda.
8.2. Propiedades fisicoquímicas.
Esta información deberá venir respaldada con las
determinaciones hechas por o para el fabricante, donde se
incluya la propiedad física o química, su valor, la
metodología y las condiciones utilizadas para la
determinación de dicha propiedad.
Cuando la sustancia activa es una mezcla de
diastereoisómeros, la información fisicoquímica deberá
enviarse para cada uno de ellos, si la misma está
disponible.
Para la determinación de las propiedades
fisicoquímicas se deberá utilizar las directrices de la
OCDE o metodología CICAP, correspondiente. Cuando dicha
evaluación no esté cubierta por éstas, podrá utilizarse
metodología de la UE, OCSPP de la EPA, según corresponda,
o protocolos que cumplan con lo establecido en el inciso
tercero del numeral 4.3.
Al finalizar las determinaciones fisicoquímicas
deberá indicarse el grado de cumplimiento de las
especificaciones pertinentes de la FAO por parte de las
sustancias activas objeto de la solicitud. Se enumerará
detalladamente los parámetros y se justificarán las
diferencias entre uno y otro.
Para el caso de usar la sustancia activa pura, se debe
informar el (los) método(s) de purificación y la pureza,
que debe ser la más alta posible. Se justificará cuando
ésta sea < 980 g/kg, debiendoo fundamentar que se agotaron las
posibilidades técnicas de obtener una mayor pureza.
Las informaciones de aspectos fisicoquímicos
comprenden:
8.2.1. Aspecto:
a. Estado físico (activo puro (p),
activo grado técnico
(t)).
b. Color (p y t).
c. Olor (p y t).
8.2.2. Punto de fusión o congelamiento (p). En caso
que la sustancia activa sublime, señalar la temperatura a
la que sublima (Punto de sublimación), o el proceso
contrario. En caso que la sustancia activa se descomponga,
señalar la temperatura a la que se descompone (Punto de
descomposición).
Punto de fusión (t), para sustancias activas
que sean sólidas sobre 0ºC. En caso que la sustancia
activa sublime, señalar la temperatura a la que sublima
(Punto de sublimación). En caso que la sustancia activa se
descomponga, señalar la temperatura a la que se descompone
(Punto de descomposición).
8.2.3. Punto de ebullición (p) para líquidos a
temperatura ambiente. En caso que la sustancia activa se
descomponga, señalar la temperatura a la que se descompone
(Punto de descomposición).
8.2.4. Densidad (p y t).
8.2.5. Presión de vapor (Pa) (p).
8.2.6. Volatilidad (p) (constante de Henry, Pa . m3 .
mol-1) (p).
8.2.7. Espectros (p): UV/VIS, IR, RMN- 1H, RMN-13C,
EM.
8.2.8. Solubilidad en agua incluido efecto del pH (de
4 a 10) (p) La determinación se realizará en medio neutro,
y en caso que la sustancia activa forme iones también se
determinará la solubilidad en agua en medios ácidos y
alcalinos.
8.2.9. Solubilidad en disolventes orgánicos (p o
t). Deberá ser determinada en los siguientes disolventes
orgánicos, indicando la temperatura aplicada:
a. Hidrocarburos alifáticos: preferentemente en
n-heptano,
b. Hidrocarburo aromático: preferentemente xileno,
c. Hidrocarburos halogenados: preferentemente
1,2-dicloroeteno,
d. Alcohol: preferentemente metanol o alcohol
isopropílico,
e. Cetona: preferentemente acetona,
f. Éster: preferentemente acetato de etilo.
En caso de incompatibilidad con el disolvente se
pueden usar disolventes alternativos, dentro
del mismo grupo.
8.2.10. Coeficiente de partición en n-octanol/agua
(p).
8.2.11. Estabilidad en agua (p).
a. Velocidad de hidrólisis (p).
b. Degradación fotoquímica (p).
c. Constante de disociación (p), incluido el efecto
del pH (de 4 a 10).
8.2.12. Inflamabilidad (t), para líquidos inflamables
o combustibles, y para sólidos, gases o sustancias que
desprendan gases inflamables.
8.2.13. Tensión superficial (p).
8.2.14. Propiedades explosivas (t).
8.2.15. Propiedades oxidantes o comburentes (t), para
sólidos o líquidos.
8.2.16. Corrosividad (t).
8.2.17. Reactividad con el material de envases (t).
8.2.18. pH (t).
8.2.19. Viscosidad (t) (para sustancias líquidas).
8.3. Aspectos relacionados con su utilidad.
Los documentos que respalden este punto, deberán ser
de carácter técnico y emitidos por el fabricante de la
sustancia activa (folletos, resúmenes, artículos de
revistas científicas).
8.3.1. Aptitud (Insecticida, herbicida, etc.)
8.3.2. Efecto sobre los organismos-plaga (ej.: tóxico
por inhalación, contacto sistémico u otras formas).
8.3.3. Organismos nocivos controlados (Nombre común y
científico)
8.3.4. Modo de acción sobre los organismos nocivos y
sobre las plantas.
8.3.5. Ámbito de aplicación previsto (en
formulaciones para uso en campo, recintos cerrados, etc.).
8.3.6. Resistencia (Información sobre desarrollo de
resistencia en los organismos que controla y estrategias de
manejo para prevenirlas).
8.4. Métodos analíticos.
8.4.1. Métodos para la sustancia activa.
Deberán facilitarse descripciones completas de la
metodología.
a. Método analítico para la determinación de la
sustancia activa pura en el grado técnico.
b. Método analítico para la
determinación tanto de impurezas relevantes como de
impurezas cuyo contenido es mayor o igual a 1 g/kg en la
sustancia activa grado técnico, y cuando corresponda de los
productos de degradación, isómeros, y aditivos (por
ejemplo: estabilizantes).
c. Parámetros analíticos: Para los métodos
anteriores deberá presentarse:
c.1. Linealidad,
c.2. Límite de detección y cuantificación,
c.3. Especificidad,
c.4. Exactitud y repetibilidad
8.4.2. Métodos para la determinación de residuos.
Los métodos deberán permitir la determinación de la
sustancia activa y/o de los metabolitos relevantes. Deberá determinarse
empíricamente e indicarse la especificidad, precisión,
recuperación y límite de cuantificación y detección.
a. Residuos en o sobre plantas, productos vegetales,
alimentos(de origen vegetal y animal) y alimentos de
animales.
b. Residuos en suelo.
c. Residuos en aguas (agua potable, aguas subterráneas
y superficiales).
d. Residuos en aire (si existen).
e. Residuos en tejidos y fluidos animales o humanos (si
existen).
8.5. Residuos en productos tratados.
8.5.1. Identificación de los productos de degradación
y metabolitos en plantas o productos tratados.
8.5.2. Comportamiento de los residuos de la sustancia
activa y sus metabolitos desde la aplicación a
la cosecha. Absorción, distribución o
conjugación con los ingredientes de la planta y la
disipación del producto para el medio ambiente.
8.5.3. Datos sobre residuos, obtenidos mediante pruebas
controladas. Esta información deberá venir respaldada con
terminaciones realizadas por o para el fabricante con la
sustancia activa en evaluación.
8.6. Información con respecto a la seguridad.
Respaldada con HDS emitida por el fabricante de la sustancia
activa según la Norma Chilena NCh2245 vigente, cuando se
importe o fabrique en Chile, o según la norma que
corresponda al país de origen del plaguicida, cuando no se
cumpla lo anterior, o bien una declaración en original, de
éste, donde se incluyan todas las recomendaciones para la
sustancia activa.
8.6.1. Procedimientos para la destrucción de la
sustancia activa y para su descontaminación.
8.6.2. Posibilidades de recuperación (si la
información está disponible).
8.6.3. Posibilidades de neutralización.
8.6.4. Condiciones para incineración controlada.
8.6.5. Descontaminación de aguas.
8.6.6. Métodos recomendados y precauciones de manejo
durante su manipulación, almacenamiento, transporte y en
caso de incendio o derrame.
8.6.7. Productos de reacción y gases de combustión en
caso de incineración o incendio.
8.6.8. Información sobre equipos de protección
individual.
8.7. Toxicología.
El solicitante deberá presentar copia de los ensayos
generados por o para el fabricante de la sustancia activa
que va a ser evaluada, y cuando corresponda, autorización
del titular de dicha información para usarla para la
autorización que se solicita. Se debe identificar
claramente el laboratorio, indicando las fechas de inicio y
de término de los estudios, los responsables técnicos y de
calidad del estudio, las declaraciones de confidencialidad
de la información y de aseguramiento de calidad, el
protocolo del ensayo, y adjuntando las observaciones, el
resultado de la determinación, incluyendo las tablas
resúmenes, los puntos finales y la conclusión, y para cada
estudio en particular, lo señalado por el protocolo
utilizado. Todos los estudios deben corresponder a la
sustancia activa que va a ser evaluada.
Se deberá utilizar las directrices de la OCDE u OCSPP
de la EPA, o protocolos que cumplan con lo establecido en el
inciso tercero del numeral 4.3.
En todos los estudios se deberá indicar la dosis real
alcanzada y utilizada en mg/kg de masa corporal, así como
cualquier otra unidad adecuada.
8.7.1. Toxicidad Aguda.
a. Oral (ratas activo grado técnico).
b. Dérmica (ratas activo grado técnico).
c. lnhalatoria (ratas activo grado técnico).
d. Irritación cutánea (conejos activo grado
técnico).
e. Irritación ocular (conejos activo grado técnico).
f. Sensibilización cutánea (activo grado técnico).
8.7.2. Toxicidad a Corto Plazo/Mediano Plazo.
a. Oral acumulativa (estudio de 28 días, ratas, activo
grado técnico).
b. Administración oral (90 días, activo grado
técnico).
b.1. en roedores (ratas).
b.2. en no roedores (especie determinada en los
protocolos OCDE u OCSPP de la EPA).
c. Otras vías:
c.1. Inhalación (28 días, ratas, activo grado
técnico,(sustancias volátiles)).
c.2. Dérmica (21/28 días, ratas o conejos, activo
grado técnico).
8.7.3. Toxicidad crónica.
a. Oral a largo plazo.
b. Carcinogenicidad.
8.7.4. Mutagenicidad.
a. Estudios in vitro.
a.1. Ensayo de mutación inversa en bacterias.
a.2. Ensayo de clastogenicidad en células de
mamífero u otros (Ensayo de aberraciones cromosómicas in
vitro en mamíferos).
a.3. Ensayo de mutación génica en células de
mamífero.
b. Estudio in vivo en células somáticas.
Si todos los estudios in vitro son negativos, se
deberá realizar un estudio in vivo en células somáticas
(ensayo de mutación genética, aberraciones cromosómicas o
efectos en el ADN), con demostración de la exposición del
tejido de ensayo.
En el caso que en los ensayos in vitro se obtengan
resultados equívocos o positivos, la selección de los
ensayos in vivo a realizar deberá continuar con la línea
de evaluación de mutagenicidad presentada en el estudio in
vitro.
Si el resultado del ensayo citogénico in vitro resulta
positivo, se deberá llevar a cabo un ensayo in vivo de
micronúcleos o en médula ósea. Si el resultado del ensayo
de mutación génica in vitro resulta positivo, se deberá
llevar a cabo un ensayo in vivo que analice la síntesis no
programada de ADN.
Al realizar los estudios de genotoxicidad in vivo,
deberá haber pruebas convincentes de que con la vía de
exposición y el método de aplicación escogidos se
llegará al tejido pertinente.
Deberá evaluarse la posibilidad de realizar un estudio
in vivo, como parte de uno de los estudios de toxicidad a
corto plazo.
c. Estudio in vivo en células germinales, cuando
corresponda.
Con respecto a la mayoría de las sustancias activas
reconocidas como mutágenos de células somáticas in vivo,
no serán necesarios más ensayos de genotoxicidad, pues se
considerará que son potenciales carcinógenos genotóxicos
y potenciales mutágenos de células germinales.
Sin embargo, cuando algún resultado de los estudios in
vivo en células somáticas sea positivo, podrá requerirse
llevar a cabo ensayos in vivo en células germinales para
determinar si es mutágeno de este tipo de célula.
La necesidad de realizar estos ensayos deberá
decidirse caso a caso, teniendo en cuenta la información
disponible sobre toxicocinética, uso, exposición prevista
o la necesidad de demostrar si es un mutágeno de célula
somática o de célula germinal.
8.7.5. Efectos sobre la Reproducción.
a. Teratogenicidad.
b. Estudio sobre, por lo menos, dos generaciones en
mamíferos.
8.7.6. Metabolismo en Mamíferos.
a. Estudios toxicocinéticos con dosis única (ratas,
administración oral) y con dosis repetidas (ratas,
administración oral).
a.1. Absorción.
a.2. Distribución.
a.3. Excreción.
b. Estudio Toxicocinético (ratas, administración
dérmica).
b.1. Absorción dérmica.
c. Explicación de las rutas metabólicas.
8.7.7. Estudios de neurotoxicidad o neurotoxicidad
retardada.
Para el caso de la neurotoxicidad retardada, deberán
someterse las sustancias similares o estructuras afines a
las capaces de producir fenómenos de neurotoxicidad
retardada.
8.7.8. Información Médica Obligatoria.
a. Diagnóstico y síntomas de intoxicación.
b. Tratamientos propuestos:
b.1. Primeros auxilios.
b.2. Tratamiento médico.
c. Antídotos.
8.7.9. Estudios Adicionales
Efectos tóxicos de metabolitos procedentes de los
vegetales tratados, isómeros si ocurren, cuando éstos sean
diferentes de los identificados en los estudios sobre
animales.
8.7.10. Información Médica Complementaria.
Se deberá presentar artículos publicados en revistas
técnicas, científicas o informes oficiales sobre:
a. Vigilancia médica del personal de instalaciones de
fabricación.
a.1. Informes de vigilancia de salud ocupacional.
a.2. Hipersensibilidad o alergia.
b. Observación directa de casos clínicos.
c. Observación sobre la exposición de la población
en general y estudios epidemiológicos.
8.8. Efectos sobre el Ambiente.
Las copias de los estudios presentados deben ser generados por o para
el fabricante de la sustancia activa que va a ser evaluada,
y cuando corresponda, tener autorización del titular de
dicha información para usarla para la autorización que se
solicita. Se deberá identificar claramente el laboratorio,
indicando las fechas de inicio y de término de los
estudios, los responsables del área técnica y de calidad,
las declaraciones de confidencialidad de la información y
de aseguramiento de calidad, el protocolo del estudio, y
adjuntando las observaciones, el resultado de la
determinación, incluyendo las tablas resúmenes y la
conclusióante deberá presentar las copias de
los estudios generados por o para el fabricante de la
sustancia activa que va a ser evaluada, y cuando
corresponda, autorización del titular de dicha información
para usarla para la autorización que se solicita. Se
deberá identificar claramente el laboratorio, indicando las
fechas de inicio y de término de los estudios, los
responsables del área técnica y de calidad, las
declaraciones de confidencialidad de la información y de
aseguramiento de calidad, el protocolo del estudio, y
adjuntando las observaciones, el resultado de la
determinación, incluyendo las tablas resúmenes y la
conclusión, y para cada estudio en particular, lo señalado
por el protocolo utilizado.
Se deberá utilizar las directrices de la OCDE u OCSPP
de la EPA, o protocolos que cumplan con lo establecido en el
inciso tercero del numeral 4.3.
8.9.1 Efectos sobre las Aves.
8.9.1.1. Toxicidad oral aguda. Estudio para una
especie (codorniz japonesa o americana, o ánade real).
8.9.1.2. Toxicidad a corto plazo (estudio en una
especie/8 días)
8.9.1.3. Efectos en la reproducción.
8.9.2 Efectos sobre Organismos Acuáticos.
8.9.2.1. Toxicidad aguda para peces. Estudio para
una especie (Trucha arcoíris) De contar con estudios de una
segunda especie, estos deberán ser presentados al Servicio.
8.9.2.2. Ensayo de toxicidad en las
primeras fases de vida de los peces.
8.9.2.3. Ensayo sobre el ciclo vital
completo de los peces
8.9.2.4. Bioacumulación en peces.
8.9.2.5. Toxicidad aguda para los invertebrados
acuáticos. Estudio para una especie (Daphnia sp.) De contar
con estudios de una segunda especie (insectos acuáticos,
crustáceos (distinto de dáfnidos) y moluscos gasterópodos
acuáticos) estos deberán ser presentados al Servicio.
8.9.2.6. Estudios crónicos en Daphnia sp.
8.9.2.7. Tasa de reproducción para Daphnia sp.
8.9.2.8. Ritmo de crecimiento para Daphnia sp.
8.9.2.9. Efectos sobre el crecimiento de las algas.
Incluyendo las siguientes variables de respuesta:
rendimiento y tasa de crecimiento. Para los herbicidas debe
incluirse una segunda especie de un grupo taxonómico
diferente.
8.9.3 Efectos sobre Organismos Distintos al
Objetivo.
8.9.3.1. Toxicidad para abejas
a. Toxicidad aguda oral y de contacto
b. Ensayo sobre la alimentación de colonias de abejas
(Para el caso de Regulador de Crecimiento de Insectos).
8.9.3.2. Toxicidad aguda para artrópodos
benéficos. Para uno de ellos y los otros en forma
complementaria.
a. Estudio para himenóptero parasitoide
(Aphidius rhopalosiphi).
b. Estudio para ácaro depredador (Typholodromus pyri).
c. Estudios para dos especies relacionadas con la
aplicación del plaguicida (Preferentemente depredador
terrestre y depredador de follaje).
8.9.3.3. Toxicidad para lombrices de tierra (Eisenia
foetida).
8.9.3.4. Toxicidad para microorganismos del suelo no
objetivo.
a. Transformación de nitrógeno.
b. Mineralización de carbono.
8.10. Información complementaria para proceso de
evaluación de sustancia activa.
Sin perjuicio de lo anterior, el Servicio podrá
solicitar información complementaria y estudios adicionales
para el proceso de evaluación, debiendo cumplir con lo
dispuesto en el numeral 6.2.3.
9. Requisitos técnicos para la evaluación de productos
formulados.
Se deberán presentar los siguientes antecedentes:
9.1. Descripción general.
9.1.1. Fabricante del producto formulado.
a. Nombre (y RUT si es nacional).
b. Dirección de la planta. Se
establece la siguiente secuencia de criterios priorizados,
en donde el documento a presentar debe contener, al menos,
lo siguiente:
i) Indicar la dirección de la planta donde se fabrica
o produce el producto formulado,
ii) Indicación explícitamente que en dicha planta se
fabrica o produce el producto formulado en cuestión, y
iii) Este documento deberá presentarse con la
apostilla del país de dicha planta. La prioridad es la
siguiente:
1º Certificado emitido por la Autoridad Competente del
país de origen,
2º Certificado emitido por la Cámara de Comercio del
país de origen,
3º Certificado emitido por el fabricante. Cuando se
presente un documento prioridad 2 o 3, se deberá justificar
debidamente la no presentación del documento de mayor
prioridad.
9.1.2. Fabricante de la(s) sustancia(s) activa(s).
a. Nombre (y RUT si es nacional).
b. Dirección.
9.1.3. Nombre comercial.
9.1.4. Código experimental.
9.1.5. Otros nombres.
9.1.6. Clase de uso a que se destina o Aptitud
(herbicida, insecticida, etc.).
9.1.7. Tipo de formulación (polvo mojable,
concentrado emulsionable, etc.).
9.1.8. Países de destino a los que se exportará,
cuando corresponda a un plaguicida de formulación nacional.
9.2. Composición.
La información de los puntos 9.2.1. a 9.2.3., deberá
venir respaldada con certificado de composición
cualicuantitativo emitido por el fabricante del producto
formulado.
El contenido deberá expresarse en % en masa y en g/kg
o g/l.
Para el caso de la información de un coformulante que
no queda debidamente respaldado con la HDS correspondiente,
se solicitará información adicional o estudios en base a
lo establecido en el numeral 8.
9.2.1. Sustancia(s) activa(s).
a. Identificación de la sustancia activa. Nombre
común, nombre químico UIQPA y CAS, número CAS, CE y
CICAP, indicando sales, ésteres, aminas, aniones o cationes
presentes.
b. Contenido de sustancia activa grado técnico.
c. Contenido de sustancia activa pura.
9.2.2. Métodos para el análisis de la sustancia
activa.
a. Método de análisis para la determinación de la
sustancia activa en la formulación. En caso que la
formulación contenga más de una sustancia activa se
deberá establecer un método que sea capaz de determinar
cada una de ellas en presencia de las otras sustancias
activas.
b. Métodos analíticos para la
determinación de impurezas relevantes que pueden formarse
durante la fabricación del producto formulado o por su
degradación durante el almacenamiento.
c. Parámetros analíticos:
c.1. Linealidad.
c.2. Límite de detección y cuantificación.
c.3. Especificidad.
c.4. Exactitud y repetibilidad.
9.2.3. Coformulantes.
a. Identificación del coformulante. Nombre común,
nombre químico UIQPA y CAS, fórmula estructural, número
CAS y CE, o cuando sea una mezcla indicar la identidad de
los componentes, y nombre comercial.
b. Contenido.
c. Función.
d. Información toxicológica, ecotoxicológica o
ambiental. Respaldar con HDS del proveedor del
coformulante.
El Servicio mediante resolución podrá restringir o
prohibir la utilización de coformulantes que tengan efectos
mutagénicos, teratogénicos, cancerígenos, neurotóxicos o
inmunotóxico
9.3. Propiedades físicas y químicas
Utilizar e indicar en cada caso, la metodología de
determinación siguiente, según corresponda: OCDE, UE,
OCSPP de la EPA, CICAP, o protocolos que cumplan con lo
establecido en el inciso tercero del numeral 4.3.
Esta información deberá venir respaldada con las
determinaciones hechas por el fabricante del producto
formulado o un laboratorio que preste el
servicio, o bien, con Certificado Original, emitido por
éste, donde se incluya la propiedad física y química, su
valor y la metodología de determinación de dicha
propiedad.
Al finalizar las determinaciones fisicoquímicas
deberá indicarse el grado de cumplimiento de las
especificaciones pertinentes de la FAO por parte del
producto formulado objeto de la solicitud. Se enumerará
detalladamente los parámetros y se justificarán las
diferencias entre uno y otro.
9.3.1 Aspecto
9.3.1.1 Estado físico
9.3.1.2 Color
9.3.1.3 Olor
9.3.2. Estabilidad en el almacenamiento
(efectos de la temperatura respecto de su composición y de
las propiedades físicas relacionadas con el uso) y la vida
útil.
9.3.3. Densidad relativa (D20°C4°C),
densidad absoluta (þ) y densidad aparente.
9.3.4. Inflamabilidad
9.3.4.1 Para líquidos inflamables o combustibles.
9.3.4.2 Para sólidos, gases o sustancias que
desprendan gases inflamables.
9.3.5. Acidez/Alcalinidad y pH.
9.3.6. Explosividad.
9.3.7. Propiedades oxidantes o comburentes, para
sólidos o líquidos.
9.4. Propiedades físicas y químicas
relacionadas con el uso.
Utilizar e indicar, en cada caso, la metodología de
determinación siguiente, según corresponda: OCDE, UE,
OCSPP de la EPA, CICAP o protocolos que cumplan con lo
establecido en el inciso tercero del numeral 4.3.
Esta información deberá venir respaldada con las
determinaciones hechas por el fabricante del producto
formulado o un laboratorio que preste el servicio, o bien,
con el Certificado original emitido por este, donde se
incluya la propiedad física o química, su valor y la
metodología de determinación de dicha propiedad.
Al finalizar las determinaciones fisicoquímicas
deberá indicarse el grado de cumplimiento de las
especificaciones pertinentes de la FAO por parte del
producto formulado objeto de la solicitud. Se enumerará
detalladamente los parámetros y se justificarán las
diferencias entre uno y otro.
9.4.1. Humectabilidad.
9.4.2. Persistencia de espuma.
9.4.3. Suspensibilidad.
9.4.4. Análisis granulométrico en húmedo.
9.4.5. Análisis granulométrico en seco.
9.4.6. Estabilidad de la emulsión.
9.4.7. Corrosividad.
9.4.8. Incompatibilidad con otros productos (ej:
fitosanitarios y fertilizantes).
9.4.9. Densidad relativa a 20°C
(D20°C20°C).
9.4.10. Punto de inflamación.
9.4.11. Viscosidad.
9.4.12. Índice de sulfonación.
9.4.13. Dispersión.
9.4.14. Desprendimiento de gas.
9.4.15. Soltura o fluidez.
9.4.16. Índice de yodo e índice de saponificación.
9.4.17. Solubilidad/miscibilidad en agua.
9.4.18. Solubilidad/miscibilidad en disolventes
orgánicos.
9.4.19. Tensión superficial de disoluciones acuosas.
9.4.20. Otras propiedades para formulaciones
específicas.
9.5. Datos sobre la Aplicación
Este punto deberá venir respaldado por los resultados
de los ensayos de eficacia oficiales en original y firmados
por el investigador, efectuados mediante protocolos
universalmente aceptados en que se demuestre la eficacia del
plaguicida, cuya autorización se solicita, para los fines a
los cuales se recomienda. Indicando el número de la
muestra, fecha y número de resolución que autorizó el
ingreso de la muestra experimental o bien por la
certificación de eficacia en original.
9.5.1. Ámbito de aplicación (campo, invernáculo,
etc.).
9.5.2. Efectos sobre las plagas y en los vegetales
9.5.3. Condiciones en que el producto puede, o no,
ser utilizado
9.5.4. Instrucci�nes de Uso
9.5.4.1. Cultivo
9.5.4.2. Plaga u organismo a controlar (indicando su
nombre común y científico)
9.5.4.3. Dosis.
9.5.4.4 Número y momentos de aplicación.
9.5.4.5 Métodos de aplicación.
9.5.4.6 Tiempo de reingreso al área tratada.
9.5.4.7 Períodos de carencia
9.5.4.8 Efectos sobre cultivos siguientes
9.5.4.9 Fitotoxicidad
9.5.5. Usos aprobados en otros países,
9.5.6 Estudios experimentales extranjeros, deben ser
efectuados mediante protocolos universalmente aceptados, en
que se demuestre la eficacia del plaguicida para los fines a
que se recomienda.
9.5.7 Etiquetas y folletos originales con que el
plaguicida, cuya autorización se solicita, se
expende en el país de origen del fabricante del producto
formulado.
9.6. Envases Propuestos
9.6.1. Envases
9.6.1.1 Tipo(s)
9.6.1.2 Material(es)
9.6.1.3 Capacidad(es)
9.6.1.4 Resistencia
9.6.1.5 Sistema de cierre.
9.6.2. Acción del producto sobre el material de los
envases.
9.6.3. Procedimientos para la descontaminación y
destino final de los envases.
9.7. Datos sobre el Manejo del Plaguicida
Respaldada con HDS emitida por el fabricante del producto
formulado, o bien una declaración en original de éste,
donde se incluyan todas las recomendaciones para el
plaguicida.
9.7.1. Método de destrucción, eliminación o
inutilización del plaguicida.
9.7.2. Identidad de los productos de combustión
originados en caso de incendio.
9.7.3. Procedimientos de limpieza y descontaminación
de los equipos de aplicación.
9.7.4. Métodos recomendados y precauciones de manejo
durante su manipulación, almacenamiento,
transporte y en caso de incendio o derrame.
9.7.5. Información sobre equipos de protección
individual.
9.8. Datos sobre residualidad
Esta información deberá venir respaldada con
determinaciones realizadas con el plaguicida en evaluación.
9.8.1 Datos de residuos obtenidos en base a ensayos
protocolizados, según las normas internacionales.
Determinar, cuando proceda, el nivel de los residuos del
plaguicida al momento de la cosecha del cultivo, en
conformidad con las instrucciones de uso.
9.9. Datos toxicológicos
Debe respaldarse a través de los estudios generados
por o para el fabricante del producto formulado que va a ser evaluado,
y cuando corresponda, con la autorización del titular de
dicha información para usarla para la autorización que se
solicita; identificando claramente la identidad del
laboratorio, el protocolo del ensayo, y adjuntando las
principales observaciones y el resultado de la
determinación. Todos los estudios deben corresponder al
producto que va a ser evaluado. Se deberá utilizar las
directrices de la OCDE u OCSPP de la EPA o protocolos que
cumplan con lo establecido en el inciso tercero del numeral
4.3.
9.9.1. Toxicidad aguda para mamíferos.
9.9.1.1. Oral (DL50 oral aguda, ratas, producto
formulado).
9.9.1.2. Dérmica (DL50 dermal aguda, ratas, producto
formulado).
9.9.1.3. Inhalatoria (CL50 inhalatoria, ratas, producto
formulado).
9.9.2. Irritación cutánea y ocular (conejos,
producto formulado)
9.9.3. Sensibilización cutánea. (Si no se indicó
para el técnico)
9.9.4. Informaciones Médicas Obligatorias.
9.9.4.1 Diagnóstico y síntomas de intoxicación.
9.9.4.2 Tratamientos propuestos.
9.9.4.2.1 Primeros auxilios.
9.9.4.2.2. Antídoto.
9.9.4.2.3 Tratamiento médico.
9.9.5 Informaciones médicas complementarias (cuando
estén disponibles).
9.9.5.1 Observación sobre efectos de la exposición
de la población no laboralmente expuesta y estudios
epidemiológicos.
9.9.5.2 Observación directa de casos clínicos,
accidentales y deliberados.
9.10 Datos de los efectos sobre el ambiente
Debe respaldarse a través de los estudios generados
por o para el fabricante del producto formulado que va a ser evaluado,
y cuando corresponda, con la autorización del titular de
dicha información para usarla para la autorización que se
solicita; identificando claramente la identidad del
laboratorio, el protocolo del ensayo, y adjuntando las
principales observaciones y el resultado de la
determinación. Todos los estudios deben corresponder al
producto que va a ser evaluado. Se deberá utilizar las
directrices de la OCDE u OCSPP de la EPA o protocolos que
cumplan con lo establecido en el inciso tercero del numeral
4.3.
9.10.1. Toxicidad a organismos acuáticos.
9.10.1.1 Algas
9.10.1.2 Microcrustáceos
9.10.1.3 Peces
9.10.2. Toxicidad a organismos del suelo
9.10.3. Toxicidad a aves
9.10.4. Toxicidad a abejas
9.11 Información complementaria para la evaluación del
producto formulado.
Sin perjuicio de lo anterior, el Servicio podrá
solicitar información complementaria y estudios adicionales
para el proceso de evaluación, debiendo cumplir con lo
dispuesto en el numeral 6.2.3.
TITULO III. Especificaciones del Servicio.
10. Determinación de las especificaciones del Servicio
para las sustancias activas.
El Servicio determinará las Especificaciones que
deberán cumplir las sustancias activas grado técnico, que
sean presentadas en solicitudes de evaluación tanto por
Identidad como por Equivalencia.
Estas Especificaciones considerarán principalmente lo
siguiente:
a. Especificaciones de Pureza Mínima de las sustancias
activas, de acuerdo a lo establecido por la Organización de
las Naciones Unidas para la Agricultura y la Alimentación
(FAO), por la Unión Europea u otros organismos
gubernamentales extranjeros o instituciones internacionales
reconocidas.
b. Tipos y niveles de impurezas relevantes, de acuerdo
a lo establecido por la Organización de las Naciones Unidas
para la Agricultura y la Alimentación (FAO), por la Unión
Europea u otros organismos gubernamentales extranjeros o
instituciones internacionales reconocidas.
Las Especificaciones del Servicio indicarán la
identificación de la sustancia activa (nombre común,
nombre químico, número CAS y CE) y especificaciones de
calidad (pureza mínima, identificación y contenido máximo
de impurezas relevantes).
El Servicio sustituirá las Especificaciones cuando
existan actualizaciones de la información por parte de los
organismos e instituciones internacionales.
Las nuevas Especificaciones no serán aplicables a
plaguicidas que se encuentren autorizados o en proceso de
evaluación al momento de la entrada en vigencia de las
nuevas Especificaciones.
TITULO IV. Autorización por Equivalencia.
10 bis. Determinación de los Patrones de referencia.
Para aplicar la evaluación por equivalencia, el
Servicio determinará los patrones de referencia contra los
cuales se va a comparar las sustancias activas a evaluar por
equivalencia. Dichos patrones de referencia se determinarán
considerando la información de los procesos de síntesis de
los plaguicidas que han sido evaluados y autorizados por
Identidad, de acuerdo a la presente resolución.
En los casos que el plaguicida sea sintetizado en base
a sales, aminas, ésteres, otras especies químicas o un
proplaguicida, la equivalencia se realiza sobre los procesos
de síntesis para cada una de ellas.
11. Vigencia del patrón de referencia.
El Servicio podrá sustituir el patrón de referencia
si este no cumple con las Especificaciones vigentes del
Servicio.
12. Procedimiento para la evaluación y determinación de
equivalencia de la sustancia activa grado técnico
12.1. Aplicabilidad de la evaluación por equivalencia.
La equivalencia podrá ser aplicable en los siguientes
casos:
a. Cuando la sustancia activa grado técnico proviene
de un fabricante diferente al ya registrado para esa
sustancia.
b. Cuando la sustancia activa grado técnico cambia de
escala laboratorio/piloto a escala comercial, para un mismo
fabricante de la sustancia activa.
c. Cuando cambia una o más de las siguientes
situaciones: el proceso de fabricación de la sustancia
activa, o de calidad de los materiales iniciales, o el lugar
de fabricación de la sustancia activa, o la adición de uno
o más lugares de producción.
d. ELIMINADO.
12.2. Criterios de equivalencia de sustancia activa
grado técnico
La equivalencia se determinará mediante los siguientes
criterios:
Primer nivel de evaluación de equivalencia.
a. La equivalencia de las sustancias activas grado
técnico se determinará de acuerdo a:
a.1. La pureza mínima certificada del ingrediente
activo no es menor a la del patrón de referencia
(considerando la relación de isómeros, si corresponde).
a.2. Los resultados de las evaluaciones del proceso de
fabricación usado, del perfil de impurezas y de la prueba
de mutagenicidad (bacterias, in vitro), indican que los
perfiles cumplen los requisitos del numeral 12.2.b.
b. La equivalencia de los perfiles
de impureza de las sustancias activas grado técnico se
determinará por comparación de los límites de
especificación de fabricación.
b.1. La sustancia activa grado técnico generalmente se
considerará equivalente cuando:
i) El límite máximo de cada una
de las impurezas no relevante no exceda más del 50% en
relación al nivel máximo en el perfil de referencia, o el
nivel máximo absoluto no supere más de 3 g/kg, lo que
represente el mayor aumento.
ii) Que no se presenten nuevas
impurezas relevantes,
y;
iii) Que no se incrementaron los límites de impurezas
relevantes.
b.2. Cuando se sobrepasen estos límites para las
diferencias en la concentración máxima de impurezas no
relevantes, se le solicitará al proponente suministrar las
razones y los datos de respaldo necesarios (Numeral 14.1.7),
que expliquen por qué motivo estas impurezas en particular
se pueden considerar como "no relevantes". El Servicio
evaluará en cada caso para decidir si la Sustancia activa
grado técnico es o no considerado equivalente.
b.3. Cuando hubiere impurezas nuevas, no presentes en
el patrón en concentraciones mayores o iguales a 1 g/kg, se
le solicitará al proponente suministrar las razones y los
datos de respaldo necesarios (Numeral 14.1.7), que expliquen
por qué estas impurezas son consideradas "no relevantes".
En caso de no existir documentación de respaldo que
explique esta situación deberá generarse dicha
información por medio de los estudios que correspondan. El
Servicio evaluará en cada caso si la sustancia activa grado
técnico es, o no equivalente.
b.4. El perfil de la mutagenicidad (bacterias, in
vitro) se considera equivalente al de la sustancia activa
patrón, si el resultado de la evaluación comparada, punto
final con punto final, no es peor para la sustancia activa
objeto de la solicitud.
b.5. Cuando las impurezas relevantes superen a su
máxima concentración o cuando hubieren nuevas impurezas
relevantes, la sustancia activa grado técnico no se
considerará equivalente y se denegará la solicitud
mediante resolución fundada que se notificará al
solicitante.
c. Cuando la información del primer nivel de
evaluación sea insuficiente para decidir sobre la
equivalencia o no equivalencia, se deberá proceder a
evaluar con la información disponible o generada, mediante
el segundo nivel de evaluación de equivalencia.
i. Las sustancias activas grado técnico
correspondientes a fabricantes o procesos de fabricación
distintos, se considerarán equivalentes en caso que el
primer nivel de evaluación llegue a resultados concluyentes
en tal sentido. En caso contrario, deberá someterse al
segundo nivel de evaluación de equivalencia y se estimará
a la sustancia como equivalente, sólo si los resultados de
las evaluaciones de los perfiles toxicológicos y
ecotoxicológicos del segundo nivel indiquen que los
perfiles cumplen con los requisitos de los numerales 12.2.d
y 12.2.e.
Segundo nivel de evaluación de equivalencia.
d. La equivalencia de los perfiles toxicológicos de
una sustancia activa grado técnico, se deberá determinar
de acuerdo a:
d.1. El perfil toxicológico, se considerará
equivalente al perfil toxicológico del patrón de
referencia cuando los datos requeridos en el numeral 14.2.1
(ensayos de Toxicidad Aguda) no difieran por más de un
factor de dos (2) en comparación con el perfil
toxicológico del patrón de referencia o por un factor
mayor que el de los incrementos de dosis adecuados, sí
fuera mayor de dos (2). No deberá haber ningún cambio de
evaluación en aquellos estudios que produzcan resultados
categóricos por ejemplo: categoría 1, 2 o 3 de irritación
cutánea.
d.2. Cuando fuera necesario, se evaluarán datos
toxicológicos adicionales (numerales 14.2.2.a a 14.2.2.d)
con el criterio aplicado en el numeral 12.2.d.1, siempre
que, y si corresponde, los órganos afectados sean los
mismos. La dosis de los estudios del solicitante respecto
del patrón de equivalencia no debe diferir por más de un
factor de dos (2), o los niveles sin efectos observados
(NSEO) o los niveles sin efectos adversos observados
(NSEAO), no deberán diferir en más de las diferencias en
los niveles de dosis utilizados.
e. Equivalencia de los perfiles ecotoxicológicos de
los ingredientes activos grado técnico (según corresponda
al uso previsto de la sustancia activa).
Cuando fuera necesario, el perfil ecotoxicológico
(numerales 14.2.2.e. y 14.2.2.f.) será considerado
equivalente al perfil de referencia si los datos no difieren
por más de un factor de cinco (5), comparado con el perfil
de referencia, o por un factor mayor que el de los
incrementos de dosis adecuados, si fuera mayor de cinco (5),
determinados utilizando las mismas especies.
12.3. Documentación para la evaluación y
autorización por equivalencia de la sustancia activa grado
técnico
El solicitante deberá proceder de acuerdo al numeral
4.6 y, presentar la siguiente documentación para la
evaluación del plaguicida:
a. En relación al solicitante y titular, según
corresponda, la información solicitada en el numeral 4.1.
b. En relación a la Sustancia Activa Equivalente, la
información solicitada en los numerales 14.1 y 5.1.
12.4 Verificación, evaluación y autorización por
equivalencia de la sustancia activa grado técnico.
12.4.1. Verificación documental de sustancia activa
grado técnico candidata a equivalente y verificación
analítica de perfil de pureza e impureza.
El Servicio verificará que la documentación de
respaldo presentada corresponda a lo exigido en la presente
Resolución. De ser así y, además cumplir con lo declarado
por el solicitante en el formulario de solicitud de
autorización, el Servicio informará al solicitante la
conformidad de la etapa de verificación documental. Si la
solicitud no reúne los requisitos señalados en la presente
Resolución, se aplicará a lo dispuesto en el artículo 31
de la ley Nº 19.880.
12.4.2. Verificación analítica.
Se procederá de acuerdo al numeral 6.2.2.
12.4.3. Evaluación de equivalencia de primer nivel
Durante la evaluación el Servicio establecerá:
a. Si la sustancia activa grado técnico es
equivalente, se procederá de acuerdo al numeral 12.4.5.
b. Si la información no permite establecer la
equivalencia en forma clara, la solicitud pasará al segundo
nivel de evaluación de equivalencia, según lo establecido
en el numeral 12.4.4, lo cual será notificado al
interesado.
c. Si se deniega la solicitud por el no cumplimiento de
los criterios de equivalencia o información incompleta, se
emitirá una resolución fundada, la que se notificará al
interesado.
12.4.4. Evaluación de equivalencia de segundo nivel
de sustancia activa grado técnico candidata a equivalente.
Para la evaluación de la equivalencia de segundo
nivel, el interesado tendrá un plazo
máximo de cuatro meses para la
presentación ante el Servicio de los estudios de toxicidad
aguda (numeral 14.2.1.), contado desde la fecha de
notificación indicada en el numeral 12.4.3.b.
Aplicará a las sustancias activas en el caso del
numeral 12.4.3.b después de la evaluación de equivalencia
de primer nivel, el Servicio procederá a la evaluación de
acuerdo al numeral 12.2.d.1.
Para el caso de requerirse los estudios adicionales del
plaguicida (sustancia activa, numeral 14.2.2.), que el
Servicio determine que se deben realizar luego de su
evaluación, se otorgará el plazo correspondiente de
acuerdo a lo requerido por él o los estudios, el que podrá
ser de 30 meses como máximo, cuando requiera de estudios
crónicos. En caso de no dar respuesta dentro del plazo
otorgado, se aplicará lo dispuesto en el artículo 43 de la
Ley Nº 19.880. El Servicio procederá a la evaluación de
acuerdo al numeral 12.2.d.2 y 12.2.e.
Finalmente, el Servicio deberá establecer que:
a. Si la sustancia activa grado técnico es
equivalente, se procederá de acuerdo al numeral 12.4.5.
b. Si la sustancia activa grado técnico no es
equivalente o no ha entregado la información requerida, se
denegará la solicitud mediante resolución fundada, la que
se notificará al interesado.
12.4.5. Resolución de autorización por equivalencia.
Habiéndose determinado la equivalencia, el Servicio
solicitará que, en un plazo de diez (10) días hábiles
contados desde que se entiende notificado, se envíen los
documentos requeridos en el numeral 5.1.
Una vez recepcionada la documentación que por este
numeral se solicita, el Servicio emitirá una resolución de
la sustancia activa equivalente, la cual será notificada al
solicitante. En caso contrario, el Servicio emitirá una
Resolución de rechazo notificándola al solicitante.
A cada sustancia activa grado técnico, autorizada por
equivalencia, el Servicio le otorgará un código
correlativo.
En el caso de solicitar autorización de un producto
formulado, se procede de acuerdo con el numeral 6 de la
presente Resolución, en lo que respecta al producto
formulado.
13. Vigencia de los plaguicidas autorizados
en base a una sustancia activa grado técnico equivalente.
El producto formulado en base a la sustancia activa
grado técnico equivalente será autorizado por primera vez,
para las combinaciones plagas-cultivo específicas y bajo
las condiciones indicadas en ésta, con una vigencia de 10
años, los que podrán ser renovables, por igual período,
si cumple con las disposiciones del establecidas por
Servicio.
PÁRRAFO SUPRIMIDO
14. Requisitos técnicos para la evaluación de sustancias
activas equivalentes.
14.1. Primer nivel de evaluación.
14.1.1. Identificación de la sustancia activa.
La información de los puntos 14.1.1.j-k-l-m, deberá
venir respaldada con certificado de composición
cualicuantitativo, emitido por el fabricante de la sustancia activa, y
por el perfil analítico de lotes.
a. Fabricante de la sustancia activa.
a.1. Nombre.
a.2. Dirección de la planta. Se
establece la siguiente secuencia de criterios priorizados,
en donde el documento a presentar debe contener, al menos,
lo siguiente:
i) Indicar la dirección de la planta donde se fabrica
la sustancia activa grado técnico,
ii) Indicación explícitamente que en dicha planta se
fabrica la sustancia activa grado técnico en cuestión, y
iii) Este documento deberá presentarse con la
apostilla del país de dicha planta. La prioridad es la
siguiente:
1º Certificado emitido por la Autoridad Competente del
país de origen,
2º Certificado emitido por la Cámara de Comercio del
país de origen,
3º Certificado emitido por el fabricante. Cuando se
presente un documento prioridad 2 o 3, se deberá justificar
debidamente la no presentación del documento de mayor
prioridad.
b. Nombre común.
b.1. Aceptado por ISO, o
b.2. Propuesto, por ISO.
c. Cualquier otro nombre común o sinónimo (si
tiene).
d. Nombre químico (aceptado o propuesto por UIQPA,
CAS).
e. Fórmula empírica, fórmula estructural
(incluyendo estereoquímica de isómeros activos si
corresponde) y masa molecular.
f. Nº CAS, Nº CE (para cada isómero o mezcla de
isómeros si corresponde) y CICAP.
g. Número de código experimental (cuando proceda).
h. Grupo químico a que pertenece.
i. Método de fabricación de la sustancia activa.
Esta información deberá venir respaldada por un
Certificado con el método de fabricación incluyendo
procedimiento de síntesis especificando las condiciones y
disolventes empleados de la sustancia activa emitido por el
fabricante de esta.
j. Grado de pureza (contenido mínimo de sustancia
activa en g/kg).
k. Isómeros.
k.1. Identificación. Nombre químico UIQPA y CAS;
nombre común, si existe; su fórmula empírica y
estructural; número CAS, CE y CICAP (Si existe), y masa
molecular.
k.2. Proporción en que se encuentran, y contenido
mínimo en g/kg para los isómeros activos. Para el caso de
los isómeros inactivos señalar el contenido máximo.
l. Impurezas y subproductos, identificándolas con su
nombre químico UIQPA y CAS; nombre común, si existe; su
fórmula empírica y estructural; número CAS, CE y CICAP
(Si existe) y masa molecular.
l.1. De contenido mayor o igual a 1 g/kg, si no tienen
efectos adversos, indicar su contenido máximo en g/kg.
El límite máximo para las impurezas relevantes
también debe estar respaldado por datos analíticos de lote
(mínimo cinco lotes de fabricación típicos) y el
proponente debe establecer las bases estadísticas para los
límites de fabricación de la sustancia activa.
l.2. De cualquier contenido, para
impurezas relevantes (aclarar y especificar los efectos
adversos observados, por ejemplo, efectos toxicológicos,
ecotoxicológicos o medioambientales, o efectos sobre la
estabilidad de la sustancia activa).
m. Aditivos (ej.: estabilizantes).
m.1. Identificación, Nombre químico UIQPA y CAS;
nombre omún, si existe; su fórmula empírica y
estructural; número CAS, CE y CICAP (Si existe), y masa
molecular.
En caso que el aditivo sea una mezcla, señalar nombre
y Nº CAS y CE de cada componente. Indicar la función de
cada uno de los aditivos.
m.2. Contenido máximo en g/kg.
n. Perfil analítico de lotes.
El solicitante analizará muestras representativas de
la sustancia activa para determinar el contenido de
sustancia activa pura, isómeros inactivos, impurezas y
aditivos, según proceda, hechos por o para el fabricante de
la sustancia activa. Los resultados analíticos comunicados
deberán recoger datos cuantitativos, en términos de g/kg
de contenido, de todos los componentes presentes en
cantidades superiores a 1 g/kg. Típicamente la fracción no
identificada y/o no contable del TC o TK no debe exceder de
20 g/kg. Se determinará e indicará el contenido real de
los componentes que sean peligrosos por sus propiedades
toxicológicas, ecotoxicológicas o medioambientales. Los
datos facilitados deberán recoger los resultados de los
análisis de muestras individuales y resumen de dichos
datos, para mostrar el contenido mínimo o máximo y el
contenido normal de cada uno de los componentes pertinentes,
si procede.
En caso de que una sustancia activa se produzca en
distintas plantas, estos datos deberán facilitarse para
cada planta.
Para los estudios de los 5 lotes de fabricación de la
sustancia activa que son realizados después de entrar en
vigencia esta normativa requieren ser con BPL.
Las bases estadísticas para los límites de
fabricación de la sustancia activa deben explicarse (por
ejemplo: nivel máximo encontrado en la práctica; la media,
más 3 veces la desviación estándar de niveles encontrados
en la práctica; etc.).
El solicitante deberá analizar muestras de sustancia
activa producidas en laboratorio o en sistemas de
producción piloto, si se ha utilizado ese material para
generar datos toxicológicos o ecotoxicológicos.
ñ. Países a los que se exportará, cuando
corresponda.
14.1.2. Propiedades fisicoquímicas.
La información deberá venir respaldada con las
determinaciones hechas por o para el fabricante de la sustancia
activa, donde se incluya la propiedad física o química, su
valor, la metodología y las condiciones utilizadas para la
determinación de dicha propiedad
Para la determinación de las propiedades
fisicoquímicas, se deberá utilizar las directrices de la
OCDE o metodología CICAP, correspondiente. Cuando no esté
cubierta por éstas, podrá utilizarse metodología de la
UE, OCSPP de la EPA, según corresponda, o protocolos que
cumplan con lo establecido en el inciso tercero del numeral
4.3.
Al finalizar las determinaciones fisicoquímicas
deberá indicarse el grado de cumplimiento de las
especificaciones pertinentes de la FAO por parte de las
sustancias activas objeto de la solicitud. Se enumerará
detalladamente los parámetros y se justificarán las
diferencias entre uno y otro.
Para el caso de usar la sustancia activa pura, se debe
informar el (los) método(s) de purificación y la pureza,
que debe ser la más alta posible. Se justificará cuando
ésta sea < 980 g/kg, debiendo fundamentar que se
agotaron las posibilidades técnicas de obtener una mayor
pureza.
Notas específicas sobre propiedades fisicoquímicas
que deben presentarse para la determinación de la
equivalencia:
(i) Los estudios y los datos sobre las propiedades
fisicoquímicas de la sustancia activa pura se requieren
solamente cuando se presume que su composición puede ser
diferente a la de la sustancia activa patrón pura (p. ej.
proporción de isómeros diferente o variable).
(ii) Se acepta la composición de la sustancia activa
pura como la misma, tanto en la sustancia activa patrón y
la sustancia activa objeto de la solicitud, cuando es un
solo compuesto aquiral, un solo enantiómero o un compuesto
quiral como mezcla racémica de un par enantiómerico.
Si la sustancia activa pura es una mezcla, excluyendo
la mezcla racémica de un par enantiomérico, se presume que
la composición de la sustancia activa pura es diferente en
la sustancia activa patrón y la sustancia activa objeto de
la solicitud sin evidencia que las composiciones sean
iguales.
(iii) Se aceptan que los datos de las propiedades
fisicoquímicas disponibles para la sustancia activa patrón
de los isómeros individuales puros de una mezcla de
isómeros aplican a los isómeros individuales puros del
material objeto de la solicitud.
(iv) Además, se requiere los estudios y los datos
cuando el valor medido de una propiedad no está en
razonable concordancia con el valor registrado de la
evaluación que respalda la especificación del patrón.
(v) Se requiere los estudios y los datos para la
solubilidad en disolventes orgánicos a temperatura ambiente
para la sustancia activa grado pura o grado técnico. Sin
embargo, si los datos de la solubilidad en disolvente para
la sustancia activa pura ya fueron registrados en la
evaluación que respalda la especificación del patrón, los
datos de la solubilidad en disolventes no se requieren para
la sustancia activa pura (o grado técnico) de la sustancia
activa objeto de evaluación, si tienen la misma
composición que la sustancia activa pura patrón.
a. Aspecto.
a.1. Estado físico (activo puro (p), activo grado
técnico (t)).
a.2. Color (p y t).
a.3. Olor (p y t).
b. Punto de fusión o congelamiento (p). En caso que
la sustancia activa sublime, señalar la temperatura a la
que sublima (Punto de sublimación), o el proceso contrario.
En caso que la sustancia activa se descomponga, señalar la
temperatura a la que se descompone (Punto de
descomposición).
Punto de fusión (t), para sustancias activas que
sean sólidas sobre 0ºC. En caso que la sustancia activa
sublime, señalar la temperatura a la que sublima (Punto de
sublimación). En caso que la sustancia activa se
descomponga, señalar la temperatura a la que se descompone
(Punto de descomposición).
c. Punto de ebullición (p), para líquidos a
temperatura ambiente. En caso que la sustancia activa se
descomponga, señalar la temperatura a la que se descompone
(Punto de descomposición).
d. Presión de vapor (Pa) (p) y volatilidad
(constante de Henry, Pa . m3. mol-1) (p).
e. Solubilidad en agua incluido efecto del pH (de 4
a 10) (p) La determinación se realizará en medio neutro, y
en caso que la sustancia activa forme iones también se
determinará la solubilidad en agua en medios ácidos y
alcalinos.
f. Solubilidad en disolventes orgánicos (p o t). Se
determinará en los siguientes disolventes orgánicos
(indicar la temperatura aplicada):
f.1. Hidrocarburos alifáticos: preferentemente en
n-heptano,
f.2. Hidrocarburos aromáticos: preferentemente
xileno,
f.3. Hidrocarburos halogenados: preferentemente 1,
2-dicloroeteno,
f.4. Alcohol: preferentemente metanol o alcohol
isopropílico,
f.5. Cetona: preferentemente acetona,
f.6. Éster: preferentemente acetato de etilo.
En caso de incompatibilidad con el disolvente se pueden
usar disolventes alternativos, dentro del mismo grupo.
g. Coeficiente de partición en n-octanol/agua (p).
h. Estabilidad en agua (p).
h.1. Velocidad de hidrólisis (p).
h.2. Degradación fotoquímica (p).
h.3. Constante de disociación (p), incluido el efecto
del pH (de 4 a 10).
14.1.3. Métodos analíticos para la sustancia activa.
Deberán presentarse las descripciones completas de la
metodología.
a. Método analítico para la determinación de la
sustancia activa pura en el grado técnico.
b. Método analítico para la determinación tanto de
impurezas relevantes como de impurezas cuyo contenido es
mayor o igual a 1 g/kg en la sustancia activa grado
técnico, y cuando corresponda de los productos de
degradación, isómeros y aditivos (por ejemplo:
estabilizantes).
c. Parámetros analíticos:
Para los métodos anteriores deberá presentarse:
c.1. Linealidad,
c.2. Límite de detección y cuantificación,
c.3. Especificidad,
c.4. Exactitud y repetibilidad.
14.1.4. Mutagenicidad.
a. Estudios in vitro.
a.1. Ensayo de mutación inversa en
bacterias.
14.1.5. Información adicional.
Se deberá presentar la siguiente información a
solicitud del Servicio, si en base a la evaluación de la
información presentada por el solicitante se identifica la
existencia de nueva(s) impureza(s) distinta(s) a las del
perfil del patrón de referencia, con el objeto de
determinar si es(son) relevante(s):
a. Identificación de la impureza.
a.1. Nombre químico de la impureza (aceptado o
propuesto por UIQPA, CAS).
a.2. Fórmula estructural (incluyendo estereoquímica
de isómeros activos si corresponde).
a.3. Nº CAS y Nº CE (para cada isómero o mezcla de
isómeros si corresponde) de la impureza.
a.4. Espectros de la impureza (p): UV/VIS, IR, RMN1H,
RMN13C, EM.
b. Información respecto a los efectos adversos de la
impureza. Esta información deberá proveerse dependiendo de
los efectos adversos de la impureza, incluyendo información
cuantitativa tal como los puntos finales de los estudios o
los valores de los parámetros medidos cuando corresponda.
b.1. Información toxicológica de la impureza.
b.2. Información medio ambiental de la impureza.
b.3. Información ecotoxicológica de la impureza.
b.4. Información fisicoquímica de la impureza
(respecto a los efectos en la estabilidad de la sustancia
activa grado técnico).
c. Ocurrencia de la Impureza. En el caso que la
evaluación del Servicio determine que existen peligros
asociados a la impureza distinta, en base a la información
aportada por el solicitante, de tipo toxicológico,
ecotoxicológico, medio ambiental o por su estructura
química, se deberá presentar:
c.1. Determinación del perfil de impurezas de lotes de
producción antes y después de almacenamiento de la
sustancia activa grado técnico.
c.2. Determinación del perfil de impurezas de lotes de
producción antes y después de almacenamiento del producto
formulado.
14.2. Segundo nivel de evaluación de Equivalencia.
14.2.1. Toxicidad aguda.
El solicitante deberá acreditar a través de copias de
los ensayos generados por o para el fabricante de la
sustancia activa que va a ser evaluada, y cuando
corresponda, autorización del titular de dicha información
para usarla para la autorización que se solicita, debiendo
identificar claramente el laboratorio, indicando las fechas
de inicio y de término de los estudios, los responsables
técnicos y de calidad del estudio, las declaraciones de
confidencialidad de la información y de aseguramiento de
calidad, el protocolo del ensayo, y adjuntando las
observaciones, el resultado de la determinación, incluyendo
las tablas resúmenes, los puntos finales, y la conclusión,
y para cada estudio en particular, lo señalado por el
protocolo utilizado. Todos los estudios deben corresponder a
la sustancia activa que va a ser evaluada. Se deberá
utilizar las directrices de la OCDE u OCSPP de la EPA o
protocolos que cumplan con lo establecido en el inciso
tercero del numeral 4.3.
En todos los estudios se deberá indicar la dosis real
alcanzada y utilizada en mg/kg de masa corporal, así como
cualquier otra unidad adecuada.
La forma de administración de la sustancia de ensayo
depende de las principales vías de exposición. Cuando la
exposición sea por fase gaseosa, puede ser adecuado
utilizar estudios de inhalación, en vez de estudios orales.
a. Oral (ratas, activo grado técnico).
b. Dérmica (ratas, activo grado técnico).
c. lnhalatoria (ratas, activo grado técnico).
d. Irritación cutánea (conejos, activo grado
técnico).
e. Irritación ocular (conejos, activo grado
técnico).
f. Sensibilización cutánea (activo grado técnico).
g. información médica complementaria
Se deberá presentar artículos publicados en revistas
técnicas, científicas o informes oficiales sobre:
g.1. Vigilancia médica del personal de instalaciones
de fabricación.
g.1.1. Hipersensibilidad o alergia.
14.2.2. Información adicional.
Debe respaldarse a través de copias de los ensayos
generados por o para el fabricante de la sustancia activa
que va a ser evaluada , y cuando corresponda, autorización
del titular de dicha información para usarla para la
autorización que se solicita, debiendo identificar
claramente el laboratorio, indicando las fecha de inicio y
de término de los estudios, los responsables técnicos y de
calidad del estudio, el protocolo del ensayo, y adjuntando
las observaciones, el resultado de la determinación,
incluyendo las tablas resúmenes, los puntos finales, y la
conclusión, y para cada estudio en particular, lo señalado
por el protocolo utilizado. Todos los estudios deben
corresponder a la sustancia activa que va a ser evaluada. Se
deberá utilizar las directrices de la OCDE u OCSPP de la
EPA o protocolos que cumplan con lo establecido en el inciso
tercero del numeral 4.3.
Será necesario investigar e informar de todos los
efectos adversos potenciales descubiertos durante los
ensayos toxicológicos de rutina (entre los que se incluyen
los efectos sobre órganos y sistemas) y por otro lado,
realizar los estudios adicionales que puedan ser necesarios
para investigar el posible mecanismo implicado, y fijar los
niveles sin efectos adversos observados (NSEAO); y por
último evaluar la importancia de dichos efectos.
En todos los estudios se deberá indicar la dosis real
alcanzada y utilizada en mg/kg de masa corporal, así como
cualquier otra unidad adecuada.
La forma de administración de la sustancia de ensayo
depende de las principales vías de exposición. Cuando la
exposición sea por fase gaseosa, puede ser adecuado
utilizar estudios de inhalación, en vez de estudios orales.
a. Toxicidad a corto plazo/mediano plazo.
a.1. Oral acumulativa (estudio de 28 días, ratas,
activo grado técnico).
a.2. Administración oral (90 días, activo grado
técnico):
a.2.1. en roedores (ratas) y, a.2.2. en no roedores (especie
determinada en los protocolos OCDE u OCSPP de la EPA).
a.3. Otras vías:
a.3.1. Inhalación (28 días, ratas, activo grado
técnico con presión de vapor p > 10-2 Pa (sustancias
volátiles)).
a.3.2. Dérmica (21/28 días, ratas o conejos, activo
grado técnico).
b. Toxicidad crónica.
b.1. Oral a largo plazo.
b.2. Carcinogenicidad.
c. Mutagenicidad.
c.1. Estudio in Vitro.
d. Efectos sobre la reproducción.
d.1. Teratogenicidad.
d.2. Estudio sobre, por lo menos, dos generaciones en
mamíferos.
e. Metabolismo en Mamíferos.
e.1. Estudios toxicocinéticos con dosis única
(ratas, administración oral) y con dosis repetidas (ratas,
administración oral).
e.1.1. Absorción.
e.1.2. Distribución.
e.1.3. Excreción.
e.2. Estudio toxicocinético (ratas, administración
dérmica).
e.2.1. Absorción dérmica.
e.3. Explicación de las rutas metabólicas.
f. Estudios de neurotoxicidad o neurotoxicidad
retardada.
Para el caso de la neurotoxicidad retardada, deberán
someterse las sustancias similares o estructuras afines a
las capaces de producir fenómenos de neurotoxicidad
retardada.
g. Ecotoxicología.
g.1. Efectos sobre las aves.
g.1.1. Toxicidad oral aguda. Estudio para una especie
(codorniz japonesa o americana, o ánade real).
g.2. Efectos sobre organismos acuáticos.
g.2.1. Toxicidad aguda para peces. Estudio para una
especie (Trucha arcoíris) De contar con estudios de una
segunda especie, estos deberán ser presentados al Servicio.
g.2.2. Toxicidad aguda para los invertebrados
acuáticos. Estudio para una especie (Daphnia sp.) De contar
con estudios de una segunda especie (insectos acuáticos,
crustáceos distinto de dáfnidos) y moluscos gasterópodos
acuáticos) estos deberán ser presentados al Servicio.
g.2.3. Efectos sobre el crecimiento de las algas.
Incluyendo las siguientes variables de respuesta:
rendimiento y tasa de crecimiento. Para los herbicidas debe
incluirse una segunda especie de un grupo taxonómico
diferente.
g.3. Efectos sobre organismos distintos al objetivo.
g.3.1. Toxicidad para abejas.
g.3.1.1. Toxicidad aguda oral y de contacto.
g.3.2. Toxicidad aguda para artrópodos benéficos.
Para uno de ellos y los otros en forma complementaria.
g.3.2.1. Estudio para himenóptero parasitoide (Aphidius
rhopalosiphi)
g.3.2.2. Estudio para ácaro depredador (Typholodromus
pyri)
g.3.2.3. Estudios para dos especies relacionadas con la
aplicación del plaguicida (Preferentemente depredador
terrestre y depredador de follaje)
g.3.3. Toxicidad para lombrices de tierra (Eisenia
foetida).
h. Información sobre Persistencia, cuando
corresponda de acuerdo a su uso.
TITULO V. AUTORIZACIONES ESPECIALES
15. Autorizaciones basadas en sustancias activas grados
técnicos o productos formulados idénticos a otros ya
autorizados.
a. Sustancia activa idéntica a una sustancia activa
de un plaguicida ya autorizado: El titular de una
autorización de un plaguicida, podrá solicitar
al Servicio una nueva autorización respecto de un producto
que contiene idéntica sustancia activa al plaguicida ya
autorizado. Para ello, deberá declarar ante Notario que la
nueva solicitud recae en una sustancia activa idéntica al
del producto del cual el titular ya cuenta con
autorización.
No será necesario acompañar a la solicitud los
antecedentes relativos a la sustancia activa que esta
Resolución exige, no obstante, deberá adjuntar un
certificado de composición cualicuantitativa que demuestre
que corresponde a la misma sustancia activa, y el Resumen
Ejecutivo con la sustancia activa en que está basado.
Para el caso en que el solicitante sea un tercero,
el titular de la autorización original deberá declarar
ante Notario su voluntad de facultar al tercero para
utilizar los datos de la sustancia ya autorizada, como
asimismo, que la nueva solicitud recae en una sustancia
activa idéntica al del producto del cual el titular ya
cuenta con autorización. En este caso, el titular del
plaguicida que posee la autorización podrá enviar
directamente al Servicio él o los certificados de
composición cualicuantitativa que demuestre que corresponde
a la misma sustancia activa.
b. Producto formulado idéntico a un plaguicida ya
autorizado: El titular de una autorización de un
plaguicida, podrá solicitar al Servicio una nueva
autorización respecto de un nuevo producto de idéntica
formulación al plaguicida ya autorizado. Para ello, deberá
acompañar a la solicitud correspondiente, declaración ante
Notario que la nueva solicitud recae en una sustancia activa
y un producto formulado idénticos a la sustancia activa y
al producto formulado del cual el titular ya cuenta con
autorización, indicación del nombre comercial, dos
ejemplares de la etiqueta con que se expenderá el producto,
los certificados de composición cualicuantitativa de la
sustancia activa grado técnico y del producto formulado que
demuestre que corresponde a la misma sustancia activa y
producto formulado, y el Resumen Ejecutivo con la
información de la sustancia activa y el producto en que
está basado.
En el caso en que exista información que cambie
con respecto a la autorización original, tal como cambios
en las instrucciones de uso (dosis – cultivo- plaga),
envases u otros, deberá actualizar el Resumen Ejecutivo y
enviar la documentación de respaldo pertinente.
Para el caso en que el solicitante sea un tercero,
el titular de la autorización original deberá declarar
ante Notario su voluntad de facultar al tercero para
utilizar los datos de la sustancia activa y del producto
formulado idéntico ya autorizado, como asimismo, que la
nueva solicitud recae en una sustancia activa y en un
producto formulado idéntico a la sustancia activa y al
producto formulado del cual el titular ya cuenta con
autorización. En este caso, el titular del plaguicida que
posee la autorización podrá enviar directamente al
Servicio él o los certificados de composición
cualicuantitativa que demuestre que corresponde a la misma
sustancia activa.
16. Autorización de plaguicidas para uso en producción
orgánica.
En el caso de los plaguicidas que soliciten
autorización para su uso en producción orgánica, el
Servicio podrá autorizar, mediante resolución fundada, la
fabricación, importación, exportación, distribución,
tenencia, venta o aplicación de dichos plaguicidas, bajo
las condiciones que indique, previa evaluación favorable
del Servicio.
16.1. En este tipo de autorización se debe tener en
consideración los siguientes casos:
a. Cuando el plaguicida no cuente con autorización
del Servicio para su uso convencional, se deberá cumplir
con la presente Resolución según lo establecido en los
numerales 6.1, 6.2.1, 6.2.2 y 6.2.3, 8, 9 y el numeral 12 y
14 en los casos que corresponda.
Si el resultado de la evaluación técnica etapa
II es favorable, la solicitud será evaluada por el Servicio
para verificar si cumple la normativa de producción
orgánica. En caso de tener observaciones, el solicitante
tendrá 30 días hábiles para responder a las mismas. Si
éste no da respuesta, se aplicará lo dispuesto en el
artículo 43 de la Ley Nº 19.880.
Si la respuesta del solicitante es satisfactoria y
el plaguicida cumple con las normas técnicas de la Ley Nº
20.089, el Servicio evaluará la etiqueta de acuerdo a lo
dispuesto en el numeral 6.2.4 y autorizará el plaguicida
para que pueda aplicarse en producción orgánica. En caso
contrario, sólo autorizará el plaguicida para aplicarse en
agricultura convencional.
b. Cuando el plaguicida ya cuente con la
autorización del Servicio para uso convencional, se deberá
solicitar una ampliación de uso, para su uso en producción
orgánica. En tal caso, el Servicio analizará y evaluará
si cumple con la normativa específica.
En caso de tener observaciones, el solicitante tendrá
30 días hábiles para responder a las mismas. Si éste no
da respuesta, se aplicará lo dispuesto en el artículo 43
de la Ley Nº 19.880.
Si la respuesta es satisfactoria, el Servicio
resolverá si el plaguicida puede aplicarse en producción
orgánica, en cuyo caso se modificará la etiqueta y se
emitirá la resolución correspondiente. En caso contrario,
sólo podrá aplicarse en agricultura convencional.
16.2 El detalle de la información que será evaluada
por el Servicio para verificar que el plaguicida cumple con
las normas técnicas de la Ley Nº 20.089, se presenta a
continuación:
i) Certificado de composición cualicuantitativa de la
sustancia activa grado técnico, emitido por el fabricante
de esta, o del extracto natural o agente de control, emitido
por el productor.
ii) Certificado de composición cualicuantitativa del
producto formulado, emitido por el fabricante de este.
iii) Certificado de Producto Libre de OGM, que no
contiene organismos genéticamente modificados o no deriva
de ellos, cuando corresponda.
iv) Certificados de proceso productivo, con los
procesos u operaciones unitarias, equipamiento, materiales y
reactivos; emitidos por el fabricante de la sustancia activa
o productor, y por el fabricante del producto formulado.
v) Certificado de Confirmación de Compatibilidad
para Uso en Agricultura Orgánica, de acuerdo a los
organismos competentes de Estados Unidos o la Unión
Europea, si están disponible
vi) Resumen Ejecutivo.
vii) HDS según la Norma Chilena NCh2245 vigente,
cuando corresponda.
viii) Etiqueta.
ix) Informe técnico del fabricante de la sustancia
activa o productor y del fabricante del producto formulado
sobre el origen de las materias primas u organismos y
proceso de obtención de éstos, y los proveedores.
x) Informe Técnico de Toxicología/Ecotoxicología
de sustancias activas, coformulantes y producto formulado.
xi) Efectos sobre enemigos naturales de las plagas
agrícolas (macro o microorganismos), si están disponibles.
xii) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
Para el caso de información adicional del plaguicida
(sustancia activa o producto formulado), correspondiente al
numeral romano xii, que el Servicio determine que se debe
entregar luego de su revisión, este otorgará el plazo
correspondiente de acuerdo a lo requerido por él o los
estudios. En caso de no dar respuesta dentro del plazo
otorgado, se aplicará lo dispuesto en el artículo 43 de la
Ley Nº 19.880.
17. Autorización de plaguicidas para uso en cultivos
menores.
Esta autorización deberá cumplir con lo establecido
en la Resolución de este Servicio que establece
disposiciones para autorizar el uso de plaguicidas en
cultivos menores, y es otorgada sobre un plaguicida para
usos en cultivos que no cuenten con plaguicidas autorizados
para su manejo fitosanitario.
18. Autorización de fabricación de plaguicidas para sólo
exportación.
Esta autorización deberá cumplir con lo establecido
en la Resolución de este Servicio que establece requisitos
para evaluación y autorización de plaguicidas formulados
sólo para exportación.
19. Autorización de ingreso o formulación de feromonas de
monitoreo.
Esta autorización deberá cumplir con lo establecido
en la Resolución de este Servicio que establece normas para
el ingreso de feromonas de monitoreo cuya regulación sea de
competencia del Servicio Agrícola y Ganadero.
Sin perjuicio de lo anterior, los
fabricantes de sustancias activas,
fabricantes de productos formulados, importadores,
fraccionadores, distribuidores, vendedores, tenedores y
usuarios deberán cumplir con la normativa de internación y
formulación nacional de plaguicidas; asimismo, deberán
mantener la HDS según la Norma Chilena NCh2245 vigente,
disponible durante el transporte y uso.
20. Autorización de muestra de plaguicida para
experimentación
El Servicio autorizará, previa evaluación favorable,
los siguientes tipos de solicitudes de muestras de
plaguicidas para experimentación:
a. Para verificar eficacia con fines de registro:
para evaluar por primera vez la eficacia de un plaguicida en
el país, por Estaciones Experimentales autorizadas por el
Servicio o bajo la supervisión de éstas.
b. Para verificar eficacia con fines de
investigación.
c. Para ensayos con fines de registro y para
investigación: para evaluar propiedades
fisicoquímicas, metodología analítica,
residuos, toxicología, ecotoxicología y efectos ambientales.
d. Autorizaciones especiales: para plaguicidas que el
Servicio determina de acuerdo a sus facultades, bajo otros
requisitos de evaluación o para usos especiales los cuales
están descritos en el punto 22 de la presente Resolución.
21. Autorización de patrones analíticos.
El Servicio autorizará el ingreso de patrones
analíticos de sustancias activas, impurezas relevantes y
metabolitos con actividad biológica, sinergizantes,
protectores y coadyuvantes para fines de evaluación,
control de calidad, verificación, muestreo en inspección
de ingreso o fabricación de la
sustancia activa, producción, formulación y
fraccionamiento, monitoreo y de estudios que respalden los
requisitos técnicos de registro, o para fines de
investigación para lo cual estará sujeto a la Resolución
de este Servicio que establece normas para el ingreso de
patrones analíticos de plaguicidas cuya regulación competa
al Servicio Agrícola y Ganadero.
Sin perjuicio de lo anterior, es deber del usuario
cumplir con la normativa vigente, en materia de
internación, y mantener la HDS según la Norma Chilena
NCh2245 vigente, disponible en el transporte o durante su
uso.
22. Autorización de plaguicidas para usos especiales.
Este tipo de autorización se podrá aplicar en las
siguientes situaciones, mediante resoluciones que dicte el
Servicio al respecto.
a. Cuando para las medidas contempladas en los
programas de prevención, control y combate de plagas,
control de criaderos y depósitos de plantas, internación
de mercaderías peligrosas para los vegetales, para las
exportaciones o para emergencia fitosanitaria, se requiera
aplicar un plaguicida que no esté autorizado por el
Servicio o se requiera autorizar para un uso distinto, éste
podrá aprobar mediante resolución fundada, su
fabricación, importación, distribución, venta, tenencia o
aplicación, bajo las condiciones que se indique.
b. Cuando para las medidas contempladas en la Ley de
Caza y su Reglamento relativas al control de especies
dañinas, se determine el uso de plaguicidas; en tal caso,
se debe cumplir con lo establecido en la Resolución de este
Servicio que aprueba el Reglamento para el Control por medio
de sustancias anticoagulantes de lagomorfos y roedores, y
otras que el Servicio dicte al respecto. Se exceptúa el
ámbito urbano o el control de ratas y ratones exóticos u
otros animales que sean calificados de control por el
Sistema Nacional de Servicios de Salud, en edificaciones o
fuera de ellas en un radio no superior a 10 m de las mismas.
c. Cuando para el control de especies dañinas y
plagas en ecosistemas naturales se determine el uso de
plaguicidas, la autorización deberá cumplir con lo
establecido en la Resolución de este Servicio que establece
los requerimientos para la autorización de plaguicidas para
el control de especies dañinas y plagas en ecosistemas
naturales.
d. Para las medidas contempladas en Sanidad y
Protección Animal, y normativa asociada, establecidas para
desinfectar los locales, ferias y el transporte u otros, el
Servicio podrá aprobar la fabricación, importación,
distribución, venta, tenencia o aplicación de plaguicidas
mediante resolución fundada, bajo las condiciones que
indique, de acuerdo al análisis técnico y aprobación de
las unidades técnicas respectivas del
Servicio.
22 bis. Autorización de plaguicidas según esquema de
reconocimiento del proceso de registro o autorización de
sustancias activas de Estados Unidos de América o la Unión
Europea.
22.bis.1. Condiciones para solicitar el reconocimiento del
registro o autorización de sustancias activas.
Se podrá aplicar este esquema de evauación sólo para
un producto formulado que contiene una sustancia activa
idéntica a un plaguicida ya autorizado por la autoridad
competente en Estados Unidos de América o en la Unión
Europea, y en la medida que se cumplan las siguientes
condiciones:
a) La sustancia activa tenga vigente su registro o
autorización ante la autoridad correspondiente y no esté
sometida a un proceso de revisión.
b) El plaguicida producido o fabricado en base a la
sustancia activa registrada o autorizada se fabrica o
produce y se utiliza en al menos un estado o país del
bloque económico en el cual se encuentra registrado o
autorizado.
c) La solicitud no corresponde a una sustancia activa
grado técnico idéntico o producto formulado idéntico de
un plaguicida que ya ha sido autorizado por este esquema de
reconocimiento.
22.bis.2. Documentación requerida para evaluación del
reconocimiento del proceso de registro o autorización de
sustancias activas.
No será necesario acompañar a la solicitud aquellos
antecedentes relativos a la sustancia activa que esta
resolución exige; no obstante, el interesado deberá
presentar la siguiente información:
a) Para el caso de una sustancia activa autorizada por
la autoridad competente en Estados Unidos de América:
i. Documento(s) oficial(es) emitido(s) por la Usepa que
acredite(n) el registro vigente de la sustancia activa y del
formulado, en ese país: Cartas de sello dorado (Gold Seal
Letter) u otro documento equivalente.
ii. Documentación con información emitida por Usepa
sobre: Información de la sustancia activa grado técnico:
pureza, contenido equivalente ácido, impurezas, impurezas
relevantes, aditivos (todo expresado en % o g/kg):
Declaración Confidencial de Fórmula (Confidential
Statement of Formula, CSF), Registro de Evaluación de Datos
(Data Evaluation Record, DER), u otros complementarios.
iii. Certificado de composición cuali-cuantitativo que
demuestre que corresponde a la misma sustancia activa, del
formulado que se quiere registrar en Chile (emitido por el
fabricante registrado en Estados Unidos).
iv. Certificado de fabricación del mismo origen
autorizado en Estados Unidos, emitido por la fábrica.
v. Certificado o documento de autorización de la
Planta de producción de la sustancia activa, emitido por la
Usepa, si es que la dirección del certificado de registro
de la sustancia activa grado técnico es distinta a la
dirección de la planta que la fabrica.
vi. Otra información que el Servicio solicite en forma
complementaria para el proceso de evaluación, en caso de
estimarlo necesario.
b) Para el caso de una sustancia activa autorizada en
la Unión Europea:
i. Documento/s oficial/es emitido/s por la autoridad
competente de la Unión Europea que acredite/n el registro
vigente de la sustancia activa y del formulado en los
países miembros.
ii. Documentación con información emitida por UE con
la Información de la sustancia activa grado técnico:
pureza, contenido equivalente ácido, impurezas, impurezas
relevantes, aditivos (todo expresado en % o g/kg): Proyecto
de Informe de Evaluación (Draft Assessment Report, DAR) u
otros documentos relacionados, cuando se trata de primer
registro o Informe de la evaluación de equivalencia, en el
caso de ser registro por equivalencia.
iii. Certificado de composición cuali-cuantitativo que
demuestre que corresponde a la misma sustancia activa, del
formulado que se quiere registrar en Chile (emitido por el
fabricante registrado en Unión Europea).
iv. Certificado de fabricación del mismo origen
autorizado en la Unión Europea, emitido por la fábrica.
v. Certificado o documento de autorización de la
Planta de producción de la sustancia activa, emitido por la
autoridad competente, si la dirección del documento oficial
de registro de la sustancia activa grado técnico es
distinta a la dirección de la planta que la fabrica.
vi. Otra información que el Servicio solicite en forma
complementaria para el proceso de evaluación, en caso de
estimarlo necesario.
Para la evaluación del producto formulado, el
solicitante debe adjuntar toda la información de acuerdo a
los requisitos indicados en la presente resolución.
Sin perjuicio de lo anterior, el Servicio podrá
solicitar información complementaria adicional para el
proceso de evaluación.
Las solicitudes serán sometidas a las etapas y plazos
descritos en la presente resolución, o aquella que la
reemplace, y el solicitante deberá pagar las tarifas
correspondientes, considerando el cumplimiento de los
requisitos administrativos y técnicos establecidos en la
presente resolución.
De este modo, durante la Etapa I de verificación
documental se realizará la revisión de la información
presentada para optar al reconocimiento de la sustancia
activa presente en la formulación, junto con la
verificación de los documentos de respaldo para el producto
formulado, de modo tal que si la documentación de respaldo
corresponde a lo exigido en la presente resolución, el
Servicio informará al solicitante la conformidad de la
etapa de verificación documental de la solicitud de su
producto.
22.bis.3. Vigencia y renovación de la autorización.
La autorización de un plaguicida de acuerdo a este
esquema tendrá una vigencia de diez (10) años, renovable
por períodos iguales y sucesivos, debiendo solicitarse su
renovación, a lo menos seis (6) meses antes a la fecha de
su vencimiento; en caso contrario, se entenderá que se
desiste de la autorización y ésta expirará al vencimiento
de los diez (10) años.
Sin perjuicio de lo anterior, esta autorización
también estará supeditada a que se mantenga vigente el
registro o la autorización de la sustancia activa en los
Estados Unidos de América o la Unión Europea, y en el caso
de que se cancele o se prohíba en alguno de estos bloques
económicos, el Servicio deberá analizar la información y
determinar la procedencia de cancelar la autorización del
producto formulado que se otorgó bajo este esquema de
reconocimiento. Dependiendo de las razones que originaron la
cancelación o prohibición de la autorización o registro
de la sustancia activa, el Servicio podrá establecer un
plazo máximo de dos (2) años para que el titular de una
autorización vigente de un producto formulado ingrese la
información correspondiente que permita completar la data
de la sustancia activa, independiente de los años que
queden para que dicha autorización en Chile expire.
TITULO VI. RECHAZO, CANCELACIÓN, SUSPENSIÓN O PROHIBICIÓN DE LA
AUTORIZACIÓN
23. El Servicio podrá rechazar la solicitud de
autorización de un plaguicida, suspender, restringir,
prohibir o cancelar una autorización ya otorgada, si por
motivos de calidad, eficacia, toxicológicos,
ecotoxicológicos o medioambientales, debidamente
fundamentados, lo hacen necesario.
El Servicio podrá someter a revisión, de oficio o por
solicitud, una o más autorizaciones ya otorgadas; si
considera que los avances tecnológicos y/o la información
técnica y científica lo hacen necesario por afectar la
calidad, eficacia, seguridad y/o la salud de las personas,
los animales y el medio ambiente. La revisión por solicitud
tendrá que ser fundada en antecedentes técnicos de
estudios, literatura científica, informes u otros, los que
deberán ser presentados ante el Servicio para su
evaluación. El Servicio, durante esta revisión, podrá
suspender la o las autorizaciones para evaluar la
información que se haya recibido referida a la sustancia
activa o al producto formulado autorizado, o si por razones
de carácter técnico lo hacen necesario. Finalmente, y una
vez evaluado, podrá restituir la autorización, modificar
la vigencia de ésta, cancelarla, o restringir o prohibir la
sustancia activa o la formulación correspondiente.
24. El Servicio podrá rechazar, suspender o cancelar la
autorización de un plaguicida, si se determina que la
documentación presentada para la autorización es falsa, o
no corresponde con el respaldo técnico que esta Resolución
exige.
TITULO VII. POST REGISTRO
25. Renovación de la autorización de un plaguicida.
La autorización vigente de un plaguicida, podrá ser
renovada por períodos iguales y sucesivos si el interesado
lo solicita, con a lo menos, seis meses de anticipación a
la fecha de término del período respectivo, adjuntando la
información (antecedentes técnicos y legales) que se ha
actualizado a la fecha, según lo indicado en los literales
a y b del presente numeral.
Si el Servicio solicita antecedentes faltantes o
adicionales para su evaluación, el solicitante tendrá 30
días hábiles para dar respuesta. En caso de no dar
respuesta, se aplicará lo dispuesto en el artículo 43 de
la Ley Nº 19.880, quedando expirada la autorización del
plaguicida o expirando esta autorización en el plazo que le
resta de vigencia, según lo que ocurra primero.
Si a la fecha del vencimiento de la autorización, la
tramitación de la solicitud de su renovación presentada
dentro de plazo aún no hubiese sido resuelta, la vigencia
de la autorización se extenderá hasta la fecha en que se
notifique la resolución que apruebe o rechace la solicitud
de renovación.
Si la renovación no se solicita, se solicita fuera del
plazo establecido o se rechaza, la autorización se
considerará expirada en la fecha de término del período
respectivo, debiendo interrumpirse la fabricación, producción,
importación o formulación del plaguicida; en el caso de
rechazo, para la determinación de la fecha de expiración,
habrá que considerar lo señalado en el párrafo anterior.
Sin embargo, se permitirá la distribución, exportación o
venta del plaguicida por un período de dos años o hasta
agotar sus existencias, según lo que ocurra primero.
Para la renovación de la autorización de un
plaguicida, deberán acompañarse a la solicitud
correspondiente, 2 ejemplares de la etiqueta autorizada con
que se expende el plaguicida, una declaración jurada simple
en que el titular declara que se han o no producido
actualizaciones de los antecedentes, una actualización de
los antecedentes especificados en el presente numeral, si
los hubiere, y el Resumen Ejecutivo debidamente actualizado,
si corresponde.
Para optar a la renovación de la autorización del
plaguicida, el titular deberá presentar la siguiente
documentación, según corresponda:
a. Para Sustancia Activa: se deberá presentar lo
establecido en los numerales, 8.4, 8.5, 8.6, 8.7, 8.8, 8.9;
cuando corresponda 8.10; y lo señalado en el numeral 5.1.a.
b. Para el Producto Formulado: se deberá presentar
lo establecido en los numerales 9.2.2, 9.6, 9.7, 9.8, 9.9,
9.10; cuando corresponda 9.11; y lo señalado en el numeral
5.2.a.
26. Modificaciones a la autorización de un plaguicida.
26.1. Obligación del titular de
informar nuevos antecedentes técnicos.
El titular de una autorización otorgada de acuerdo a
la presente resolución o normas anteriores, estará
obligado a informar al Servicio, mediante carta, sobre los
nuevos antecedentes técnicos, que haya tomado conocimiento
o que se originen y que afecten la eficacia del plaguicida
autorizado, seguridad en el uso, su calidad, o aspectos
toxicológicos, ecotoxicológicos y medioambientales, que
afecten la salud de las personas, los animales o el
medioambiente. En caso de que el titular no presente los
antecedentes correspondientes, el Servicio podrá suspender
la autorización hasta que se presente, evalúe y se
resuelva, cuando los motivos técnicos así lo ameriten.
Para esto el titular deberá adjuntar el Resumen
Ejecutivo actualizado y los siguientes antecedentes
técnicos:
a. Para Sustancia Activa: Lo indicado en los numerales,
8.4, 8.5, 8.6, 8.7, 8.8, 8.9; cuando corresponda 8.10; y lo
señalado en el numeral 5.1.a.
b. Para el Producto Formulado: Lo indicado en los
numerales 9.2.2, 9.6, 9.7, 9.8, 9.9, 9.10; cuando
corresponda 9.11; y lo señalado en el numeral 5.2.a.
c. Para la Sustancia Activa Equivalente: Lo indicado en
los numerales 14.1.3 y 5.1.a.
El Servicio evaluará los antecedentes, y tomará las
medidas correspondientes, como la inclusión de los nuevos
antecedentes en el expediente, restricciones en el uso, o la
cancelación de la autorización, u otras de acuerdo al
caso. En caso que se requiera, la modificación de algún
aspecto de la etiqueta, el titular tendrá que solicitarlo
de acuerdo a los numerales 26.2 y 27.5.1.
26.2. Modificaciones a solicitud del titular
Una vez autorizado un plaguicida, el titular de la
autorización podrá solicitar modificaciones a esta
autorización.
Para modificar la autorización de un plaguicida,
deberá proceder de acuerdo al numeral 4.6, adjuntar el
Resumen Ejecutivo debidamente actualizado en los numerales
correspondientes y siguientes antecedentes:
a. En relación al solicitante y titular, según
corresponda, de acuerdo al numeral 4.1.
b. En relación a las modificaciones de autorización
de plaguicidas, de acuerdo al numeral 27.
El Servicio verificará si la documentación de
respaldo presentada corresponde a lo exigido en la presente
Resolución. Si la solicitud cuenta con toda la información
establecida en esta normativa y cumple con lo declarado por
el solicitante en el formulario de solicitud, el Servicio
informará al solicitante la conformidad de la etapa de
verificación documental. Si la solicitud no reúne los
requisitos señalados en la presente Resolución, se estará
a lo dispuesto en el artículo 31 de la ley Nº 19.880.
Cumplido lo establecido en el párrafo anterior, el
Servicio procederá a la evaluación de la información
presentada. De identificarse observaciones a la información
presentada o de requerirse modificaciones en la etiqueta del
plaguicida, será comunicado por escrito al solicitante,
quien tendrá un plazo de 40 días hábiles
para dar respuesta. En caso de no dar respuesta, se
aplicará lo dispuesto en el artículo 43 de la Ley Nº
19.880.
Para el caso de información adicional del plaguicida
(sustancia activa o producto formulado), que el Servicio
determine que se debe entregar luego de su evaluación, se
otorgará el plazo correspondiente de acuerdo a lo requerido
por él o los estudios. En caso de no dar respuesta dentro
del plazo otorgado, se aplicará lo dispuesto en el
artículo 43 de la Ley Nº 19.880. Si los antecedentes
cumplen con lo establecido en la presente Resolución y
demuestran que el plaguicida es efectivo para el fin a que
se destina y no entraña un riesgo inaceptable para la salud
humana, animal ni para el medioambiente, se solicitará al
titular, que en el plazo de 10 días hábiles contados desde
que se entiende notificado, se envíe la etiqueta definitiva
correspondiente al plaguicida evaluado, en el formato
establecido, la HDS según la Norma Chilena NCh2245 vigente.
El Servicio aprobará cada modificación mediante
resolución, después de recibidas las etiquetas definitivas
del plaguicida, la HDS según la Norma Chilena NCh2245
vigente del producto formulado de acuerdo a lo señalado en
los numerales 5.1 o 5.2, según corresponda, y de la
sustancia activa grado técnico, cuando corresponda el caso.
Esta resolución será notificada al titular.
De no cumplirse con lo dispuesto en la presente
Resolución, el Servicio emitirá una resolución de
rechazo, que será notificada al titular.
27. Requisitos técnicos de modificaciones de
autorizaciones.
27.1. Sustitución de un producto formulado por
cambios de la composición de la sustancia activa grado
técnico.
27.1.1. Por aumento de la pureza de la sustancia activa grado
técnico.
Esta solicitud sólo será aplicable para plaguicidas
autorizados por identidad. Sólo será aplicable para la
misma sustancia activa con una pureza mínima mayor
contenida en el grado técnico del mismo fabricante de la
sustancia activa y del producto formulado de la
autorización original. La concentración de la sustancia
activa pura en el producto formulado deberá ser la misma
que en el producto ya autorizado. Asimismo, deberán
mantenerse los coformulantes del producto, pudiendo variar
sólo el contenido del coformulante que ejerce el balance en
la formulación para compensar los cambios en la sustancia
activa grado técnico.
El solicitante deberá presentar al Servicio los
siguientes documentos:
a) Para la sustancia activa grado técnico.
i) Declaración jurada del titular de la
autorización, indicando el producto y su número de
autorización.
ii) Certificado de composición cualicuantitativo de
la nueva composición, emitido por el fabricante de la
sustancia activa.
iii) Documento comparativo de la composición vigente
y de la nueva composición, emitido por el fabricante de la
sustancia activa, incluyendo una declaración de éste
indicando las razones del o los cambios.
iv) Documento comparativo emitido por el fabricante
de la sustancia activa o por quién éste encomendó, de
propiedades fisicoquímicas.
v) Declaración del fabricante de la sustancia
activa que acredite que las propiedades biológicas,
toxicológicas, medioambientales, ecotoxicológicas y de
residuos no se ven adversamente afectadas y que los
documentos que respaldaron su autorización, continúan
siendo válidos para el certificado de composición que se
está presentando. vi) HDS según la Norma Chilena
NCh2245 vigente, cuando se importe o fabrique en Chile, o
por la norma que corresponda al país de origen del
plaguicida, cuando no se cumpla lo anterior actualizada de
la Sustancia activa grado técnico.
vii) Resumen ejecutivo debidamente actualizado.
viii) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
b) Para el producto formulado.
i) Certificado de composición cualicuantitativo de
la nueva composición, emitido por el fabricante del
producto formulado.
ii) Documento comparativo del producto formulado con la
composición autorizada y la presentada en la solicitud,
emitido por el fabricante del producto formulado.
(Declaración que indique el balance realizado en la
composición del producto formulado con el coformulante que
compensa las variaciones en la sustancia activa grado
técnico).
iii) Documento comparativo emitido por el fabricante
del producto formulado o por quién éste encomendó, de
propiedades fisicoquímicas.
iv) HDS según la Norma Chilena NCh2245 vigente del
producto formulado.
v) Resumen ejecutivo debidamente actualizado.
vi) Declaración del fabricante del producto
formulado para los estudios toxicológicos y
ecotoxicológicos en el que se analice la toxicología
(aguda) del coformulante que ha cambiado, en su proporción
cuantitativa, para compensar la mayor pureza de la sustancia
activa grado técnico.
vii) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
27.1.2. Con mejora en isómeros, perfil de impurezas o
en aditivos manteniendo la misma pureza mínima de la
sustancia activa grado técnico.
Corresponde al cambio de composición de isómeros,
impurezas o aditivos manteniéndose la misma o mejor
clasificación de peligro.
Esta solicitud sólo será aplicable para plaguicidas
autorizados por identidad. Sólo será aplicable para la
misma sustancia activa con una misma pureza mínima
contenida en el grado técnico del mismo fabricante de la
sustancia activa y del producto formulado de la
autorización original. No se deberán generar nuevas
impurezas relevantes. La concentración de la sustancia
activa pura en el producto formulado deberá ser la misma
que en el producto ya autorizado. Asimismo, deberá
mantenerse los coformulantes del producto.
El solicitante deberá presentar al Servicio los
siguientes documentos:
a) Para la sustancia activa grado técnico.
i) Declaración jurada del titular de la
autorización indicando el producto y su número de
autorización.
ii) Certificado de composición cualicuantitativo de
la nueva composición, emitido por el fabricante de la
sustancia activa.
iii) Documento comparativo de la composición vigente
y de la nueva composición, emitido por el fabricante de la
sustancia activa, incluyendo una declaración de éste
indicando las razones del o los cambios.
iv) Documento comparativo emitido por el fabricante
de la sustancia activa o por quién éste encomendó, de
propiedades fisicoquímicas.
v) Declaración del fabricante de la sustancia
activa que acredite que las propiedades
biológicas, toxicológicas, medioambientales,
ecotoxicológicas y de residuos no se ven adversamente
afectadas y que los documentos que respaldaron su
autorización, continúan siendo válidos para el
certificado de
composición que se está presentando.
vi) Declaración del fabricante de la sustancia
activa para los estudios toxicológicos y ecotoxicológicos
en el que se analice la toxicología (aguda) de los
isómeros, impurezas o aditivos que han cambiado, en su
proporción cuantitativa. Además en la nueva composición
no se deberán generar nuevas impurezas relevantes.
vii) HDS según la Norma Chilena NCh2245 vigente,
cuando se importe o fabrique en Chile, o por la norma que
corresponda al país de origen del plaguicida, cuando no se
cumpla lo anterior, de la Sustancia activa grado técnico.
viii) Resumen ejecutivo debidamente actualizado.
ix) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
b) Para el producto formulado.
i) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
27.2. Sustitución del producto formulado por cambios
en la composición de los coformulantes.
Sólo será aplicable a los coformulantes incluidos en
la formulación de un producto ya autorizado y para el mismo
fabricante del producto formulado
declarado en la autorización vigente. Esto no considera
modificaciones en el contenido de la sustancia activa, ni en
el tipo (denominación y código) de formulación del
plaguicida.
27.2.1. Sustitución de la forma alotrópica de una
sustancia utilizada como coformulante.
Sustitución de una sustancia de una misma fórmula
química con distintas formas alotrópicas, manteniendo el
mismo contenido del coformulante dentro de la composición
del producto formulado.
El solicitante deberá presentar al Servicio los
siguientes documentos:
i) Certificado comparativo de la composición
cualicuantitativa del plaguicida autorizado y la del
plaguicida que contiene la forma alotrópica del
coformulante, emitido por el fabricante del producto formulado.
ii) Declaración del fabricante del producto formulado
que acredite las razones del cambio.
iii) Documento comparativo de las propiedades
fisicoquímicas del plaguicida autorizado con las del
plaguicida con la forma alotrópica del coformulante que se
solicita sustituir, y los estudios correspondientes, si
estos estuvieran disponibles.
iv) Resumen ejecutivo debidamente actualizado.
v) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
27.2.2. Sustitución de un coformulante por otro que
cumpla la misma función.
Corresponde a la sustitución de un coformulante por
otro que cumpla las mismas funciones, manteniéndose la
misma o mejor clasificación de peligro.
El solicitante deberá presentar al Servicio los siguientes documentos:
i) Certificado de la nueva composición
cualicuantitativa del producto formulado, emitido por el
fabricante del producto formulado.
ii) Documento comparativo de la composición
cualicuantitativa del plaguicida autorizado y la del
plaguicida cuyo coformulante se solicita sustituir, emitido
por el fabricante del producto formulado.
iii) Declaración del fabricante del producto
formulado que acredite las razones del cambio.
iv) Documento comparativo de las propiedades
fisicoquímicas del plaguicida autorizado con las del
plaguicida cuyo coformulante se solicita sustituir y los
estudios correspondientes si éstos estuvieran disponibles.
v) Declaración del fabricante del producto
formulado que analice comparativamente la toxicología del
coformulante vigente y la del sustituyente.
vi) Análisis técnico del fabricante del producto
formulado que acredite que las propiedades físico
químicas, biológicas (eficacia, residuos, selectividad),
toxicológicas, y ecotoxicológicas no se ven adversamente
afectadas y que los documentos que respaldaron la
autorización ya otorgada continúan siendo válidos para el
certificado de composición que se está presentando.
vii) HDS según la Norma Chilena NCh2245 vigente del
producto formulado.
viii) Actualización del Resumen ejecutivo en sus
numerales correspondientes, en cuanto al certificado de
composición del producto formulado.
ix) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
27.2.3. Inclusión de un nuevo coformulante,
modificación o eliminación en la proporción de otro
coformulante dentro de la composición.
Corresponde a la inclusión de un nuevo coformulante en
el plaguicida autorizado, pudiéndose además, modificar la
proporción o presencia de otro coformulante dentro de su
composición, de tal forma que se mejoren sus
características y se mantenga o mejore su clasificación de
peligro.
El solicitante deberá presentar al Servicio los siguientes
documentos:
i) Certificado de la nueva composición
cualicuantitativa del producto formulado, emitido por el
fabricante del producto formulado.
ii) Documento comparativo de composición
cualicuantitativa del plaguicida autorizado y la del
plaguicida cuya formulación se solicita sustituir, emitido
por el fabricante del producto formulado.
iii) Declaración del fabricante del producto
formulado que acredite las razones del cambio.
iv) Documento comparativo de las propiedades
fisicoquímicas del plaguicida autorizado con las del
plaguicida cuya formulación se solicita sustituir y sus
estudios si éstos estuvieran disponibles.
v) Datos toxicológicos del nuevo coformulante que
se va a incluir dentro de la composición (HDS).
vi) Análisis técnico del fabricante del producto
formulado que acredite que las propiedades físico
químicas, biológicas (eficacia, residuos,
selectividad), toxicológicas, y ecotoxicológicas no se ven
adversamente afectadas y que los documentos que respaldaron
la autorización ya otorgada continúan siendo válidos para
el certificado de composición que se está presentando.
vii) HDS según la Norma Chilena NCh2245 vigente del
producto formulado.
viii) Actualización del Resumen ejecutivo en sus
numerales correspondientes, en cuanto al certificado de
composición del producto formulado.
ix) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
27.3. Modificación de origen o inclusión de un
nuevo origen.
Será aplicable sólo a plaguicidas autorizados por
identidad. Se procederá a una modificación de origen o
inclusión de un nuevo origen, cuando se demuestre que el
certificado de composición cualicuantitativo de la
sustancia activa grado técnico o del producto formulado
presentado en la solicitud, es idéntico al del origen de
laautorización vigente.
27.3.1. Modificación o inclusión de nuevo origen para
la sustancia activa grado técnico.
El solicitante deberá presentar los siguientes
documentos:
i) Certificado de composición cualicuantitativo de
la sustancia activa grado técnico del nuevo origen de
ésta, emitido por el fabricante de ésta.
ii) Se establece la siguiente
secuencia de criterios priorizados, en donde el documento a
presentar debe contener, al menos, lo siguiente:
i) Indicar la dirección de la planta donde se fabrica
la sustancia activa grado técnico o se produce la sustancia
natural,
ii) Indicación explícita que en dicha planta se
fabrica la sustancia activa grado técnico o produce la
sustancia natural en cuestión, y
iii) Este documento deberá presentarse con la
apostilla del país de dicha planta. La prioridad es la
siguiente:
1º Certificado emitido por la Autoridad Competente del
país de origen,
2º Certificado emitido por la Cámara de Comercio del
país de origen,
3º Certificado emitido por el fabricante. Cuando se
presente un documento prioridad 2 o 3, se deberá justificar
debidamente la no presentación del documento de mayor
prioridad.
iii) Actualización del Resumen ejecutivo en sus
numerales correspondientes, en cuanto al certificado de
composición de la sustancia activa grado técnico.
iv) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
27.3.2. Modificación o inclusión de nuevo origen para
el producto formulado.
El solicitante deberá presentar los siguientes
documentos:
i) Certificado de composición cualicuantitativo del
nuevo origen del producto formulado emitido
por el fabricante de este.
ii) Se establece la siguiente
secuencia de criterios priorizados, en donde el documento a
presentar debe contener, al menos, lo siguiente:
i) Indicar la dirección de la planta donde se fabrica
o produce el producto formulado,
ii) Indicación explícita que en dicha planta se
fabrica o produce el producto formulado en cuestión, y
iii) Este documento deberá presentarse con la
apostilla del país de dicha planta. La prioridad es la
siguiente:
1º Certificado emitido por la Autoridad Competente del
país de origen,
2º Certificado emitido por la Cámara de Comercio del
país de origen,
3º Certificado emitido por el fabricante. Cuando se
presente un documento prioridad 2 o 3, se deberá justificar
debidamente la no presentación del documento de mayor
prioridad.
iii) Actualización del Resumen ejecutivo en sus
numerales correspondientes, en cuanto al certificado de
composición del producto formulado.
iv) Dos ejemplares de la etiqueta con las
modificaciones propuestas.
v) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
27.4. Inclusión de modificaciones en el uso.
Corresponde a las modificaciones que puedan darse para
el uso de plaguicidas ya autorizados por el Servicio.
27.4.1. Inclusión de nuevos usos, ya sean éstos para
nuevos cultivos, plagas, dosis, momento de aplicación, y en
otros usos propuestos.
El solicitante deberá presentar los siguientes
documentos:
i) Estudio de eficacia para el nuevo uso, el que
deberá estar comprobado en alguna de las Estaciones
Experimentales autorizadas por el Servicio.
ii) Dos ejemplares de la etiqueta con las
modificaciones propuestas.
iii) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
iv) Resumen ejecutivo debidamente actualizado.
27.4.2. Cuando el uso solicitado corresponda a una
misma combinación plaga-cultivo de un uso autorizado
previamente para otro plaguicida con igual concentración de
ingrediente activo puro y misma formulación.
El solicitante deberá presentar los siguientes
documentos:
i) Estudio de eficacia para el nuevo uso, el que
deberá estar comprobado en alguna de las Estaciones
Experimentales autorizadas por el Servicio, o Certificación
de eficacia otorgada por la Estación Experimental.
ii) Dos ejemplares de la etiqueta con las
modificaciones propuestas.
iii) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
iv) Resumen ejecutivo debidamente actualizado.
27.5. Otras modificaciones.
Corresponde a las modificaciones que puedan darse para
el uso de plaguicidas ya autorizados por el Servicio.
27.5.1. Modificación de etiqueta o aspectos formales
del expediente.
Para los cambios de nombre comercial, modificaciones en
el texto de la etiqueta que no involucren el uso del
producto, eliminación de usos (cultivos o plagas), o
modificación de aspectos formales del expediente, entre
otros, el solicitante deberá presentar los siguientes
documentos:
i) Razones de la modificación.
ii) Dos ejemplares de la etiqueta con las
modificaciones propuestas.
iii) Otra información y antecedentes técnicos que el
Servicio requiera de acuerdo al caso en estudio.
iv) Resumen ejecutivo debidamente actualizado.
27.5.2. Modificación del titular.
Para los cambios de representante legal, de dirección
o traspaso de titular, el solicitante deberá presentar los
siguientes documentos:
i) Escritura pública, para cambio de representante
legal o del nuevo titular.
ii) Carta del titular vigente de intención de ceder
de esta condición a otra persona, para cambio de titular y
Carta del titular nuevo de aceptación del traspaso, ambas
legalizadas ante notario, para traspaso de titular.
iii) Otra información que el Servicio requiera de
acuerdo al caso en estudio.
iv) Resumen ejecutivo debidamente actualizado.
27.5.3. Modificación o inclusión de un nuevo destino.
Se procederá a una modificación de destino o
inclusión de un nuevo destino, cuando se demuestre que la
sustancia activa grado técnico o el producto formulado se
encuentre registrado o en proceso de autorización en el
país de destino.
27.5.3.1. Modificación o inclusión de nuevo destino
para la sustancia activa grado técnico. El solicitante
deberá presentar los siguientes documentos:
i) Certificado emitido por la
autoridad competente del país del nuevo destino, en el cual
se demuestre que esa sustancia activa grado técnico o
sustancia natural está autorizada en ese país con la
apostilla correspondiente, o un documento en que conste que
se encuentra en proceso de autorización.
ii) Actualización del Resumen Ejecutivo en sus
numerales correspondientes, en cuanto al certificado de
composición de la sustancia activa grado técnico.
27.5.3.2. Modificación o inclusión de nuevo destino
para el producto formulado.
El solicitante deberá presentar los siguientes
documentos:
i) Certificado emitido por la
autoridad competente del país del nuevo destino, en el cual
se demuestre que ese producto formulado está autorizado en
ese país con la apostilla correspondiente, o un documento
en que conste que se encuentra en proceso de autorización.
ii) Actualización del Resumen Ejecutivo en sus
numerales correspondientes, en cuanto al certificado de
composición del producto formulado.
28. Tratamiento de la información no divulgada.
A la información entregada por el interesado le será
además aplicable, en lo que corresponda, la Ley de
Propiedad Industrial u otra normativa complementaria, en
cuanto a la protección de la información no divulgada.
El Servicio establecerá las medidas de resguardo
necesarias en cuanto al personal y de instalaciones para
asegurar un adecuado manejo y seguridad de la información
que se encuentre bajo protección de información no
divulgada.
Entre otras medidas, la información confidencial será
archivada en las instalaciones que a tal efecto disponga
especialmente el Servicio. Cuando corresponda, esa
información será proporcionada a los funcionarios
evaluadores, no pudiendo los mismos efectuar copias ni
totales ni parciales, ni compartir la misma o darla a
conocer a terceros; concluida la evaluación, la
información confidencial será devuelta y archivada en las
instalaciones especialmente destinadas para ello.
29. Fiscalización de plaguicidas autorizados.
El Servicio fiscalizará la fabricación, importación,
exportación, distribución, venta, tenencia y aplicación
de plaguicidas. Para esto, podrá exigir se compruebe que la
o las sustancias activas y coadyuvantes, como también los
sinergizantes y protectores, cumplen en pureza y contenido
declarado; se cumple con los límites máximos de impurezas
relevantes y los coformulantes cumplen en contenido
declarado. Asimismo, el Servicio podrá exigir que se
compruebe el cumplimiento de las propiedades fisicoquímicas
en su especificación de calidad de las sustancias activas y
productos formulados indicadas en el proceso de
autorización, y exigir que se compruebe que el producto
formulado contiene la o las sustancias activas,
coadyuvantes, sinergizantes, protectores y coformulantes en
los contenidos declarados en el proceso de autorización,
considerando las tolerancias establecidas por el Servicio y
no contenga sustancias químicas o biológicas extrañas a
las indicadas en la autorización.
Los procedimientos de toma de muestra correspondientes
para estas fiscalizaciones, estarán sujetos a lo
establecido en la Resolución de este Servicio que aprueba
procedimientos de internación y formulación nacional de
plaguicidas de uso agrícola, lo establecido en la
Resolución de este Servicio que fija tolerancias para la
interpretación de los análisis de contenidos de
plaguicidas y a otras que el Servicio dicte a este respecto.
En caso de no cumplir con los requisitos que permitieron su
autorización, el Servicio podrá ordenar la retención,
comiso, reexportación o eliminación del plaguicida, según
corresponda.
Con el objeto de llevar a cabo la verificación
analítica, como parte del proceso de fiscalización, el
Servicio podrá solicitar patrones analíticos de la
sustancia activa, incluyendo sinergizantes, protectores,
coadyuvantes y sustancias naturales o de las impurezas
relevantes, u otros cuando corresponda, en cantidades
suficientes para la determinación analítica. En caso que
la sustancia activa posea isómeros activos, u otras formas
químicas o biológicas, los patrones analíticos se
solicitarán según corresponda el caso.
Las verificaciones se realizarán en laboratorios del
Servicio o en los que éste determine.
El Servicio podrá verificar en las sustancias activas
grado técnico que se fabrican, produzcan o se importan para
producir los plaguicidas autorizados, correspondan a la
pureza mínima, según proceda. Cuando la especificación
del Servicio lo señale, considerará el contenido de
impurezas relevantes.
30. Otras disposiciones
30.1 La autorización de estaciones experimentales
para comprobar eficacia, estará sujeta a la Resolución de
este Servicio que establece normas para autorizar estaciones
experimentales destinadas a probar plaguicidas. La
autorización de laboratorios de ensayos y otros cuyos
estudios respalden los requisitos técnicos para evaluar los
plaguicidas, estará sujeta a la Resolución que el Servicio
dicte para estos efectos.
30.2 Los fabricantes de sustancias activas,
productores, importadores, fabricantes de productos
formulados, fraccionadores, exportadores y distribuidores de
plaguicidas, deberán informar el inicio de sus actividades
mediante el Formulario establecido por el Servicio, en un
plazo máximo de 30 días de acontecido para la
verificación del cumplimiento de las obligaciones
contenidas en la presente Resolución; cualquier cambio de
lo informado a través del Formulario, deberá comunicarlo
al Servicio dentro de los 30 días siguientes a su
ocurrencia.
30.3.3. El plaguicida se
identificará mediante un código de lote, esto es, una
clave que permita individualizarlo en cualquiera de las
etapas de fabricación, producción, importación,
exportación, fraccionamiento, distribución y venta.
Las claves estarán formadas por números o por
combinaciones de letras y números, debiendo incluir, a lo
menos, el mes y el año de fabricación y el número
correspondiente a la partida.
30.4. El proceso de fabricación o fraccionamiento de
cada lote de producto formulado o fabricación o producción
de una sustancia activa grado técnico, según corresponda,
deberá quedar consignado en documentos foliados o archivos
digitales, los que deberán mantenerse respecto de cada lote
fabricado, por tres años a contar de la fecha de
fabricación, producción o fraccionamiento, según
corresponda.
30.5. Todo local de venta de plaguicidas deberá
mantener un documento foliado o archivo digital, en el que
se consigne, a lo menos, el nombre comercial, número de
autorización del SAG, código del lote y cantidad del
producto vendido y el nombre y dirección del comprador.
30.6. Los fabricantes de sustancias activas,
productores, importadores, fabricantes de producto
formulados, fraccionadores, exportadores y distribuidores de
plaguicidas autorizados deberán mantener un documento
foliado o archivo digital, en el que se consigne, a lo
menos, el nombre comercial, número de autorización del
SAG, código del lote y cantidad del producto vendido y el
nombre y dirección del comprador.
31. De las responsabilidades sobre los plaguicidas
autorizados.
31.1. Los fabricantes de sustancias activas,
productores, importadores, fabricantes de productos
formulados, fraccionadores y exportadores de plaguicidas
autorizados, deberán asumir la responsabilidad de los
resultados que el plaguicida produjera, derivados de
factores atribuibles a su responsabilidad. Esta
autorización, no podrá usarse como garantía de eficacia
del plaguicida autorizado ni podrá hacerse al Servicio
partícipe de la responsabilidad que con respecto al mismo,
le cabe al titular de la autorización o al fabricante de
sustancia activa, productor, importador, fabricante de
producto formulado, fraccionador, exportador o distribuidor
del plaguicida, según corresponda.
31.2. Cada fabricante de sustancia activa, productor,
importador, fabricante de producto formulado y distribuidor,
será responsable, según lo determine el Servicio, de la
recuperación oportuna y expedita de un lote en cualquier
parte de la cadena de comercialización o producción,
cuando los plaguicidas no correspondan con lo autorizado, o
se encuentren vencidos, suspendidos, prohibidos o
cancelados, adulterados, falsificados o alterados.
31.3. Previo al retiro de un plaguicida del mercado, el
responsable deberá comunicar al Servicio indicando el
motivo y disposición final de éste.
32. La presente Resolución entrará en vigencia 12 meses
después de la publicación en el Diario Oficial.
33. Derógase la Resolución Exenta del Servicio Nº 3.670
de 1999, que establece normas para la evaluación y
autorización de plaguicidas.
TITULO VIII. DISPOSICIONES TRANSITORIAS
34. Los plaguicidas en proceso de evaluación al momento de
la entrada en vigencia de esta Resolución, continuarán
siendo evaluados de acuerdo a la normativa vigente a la
fecha de la presentación de la solicitud de la
autorización.
35. Los titulares de las autorizaciones de los plaguicidas autorizados
bajo la resolución Nº 3.670, de 1999, de este Servicio,
podrán renovar dichas autorizaciones conforme a los plazos
y el proceso contemplados en el numeral 25 de la presente
resolución.
Sin embargo, solo deberán presentar los siguientes
documentos:
a. La solicitud correspondiente;
b. 2 ejemplares de la etiqueta con que se expende el
producto;
c. Una actualización de los antecedentes
toxicológicos agudos y crónicos, ecotoxicológicos,
ambientales, de residuos, de seguridad, métodos analíticos
y de uso, si corresponde; y
d. Resumen Ejecutivo debidamente
actualizado.
36. El titular de una autorización de plaguicida
autorizado de acuerdo a la resolución Nº 3.670, de 1999,
de este Servicio, estará obligado a informar al Servicio,
por escrito, las novedades, debidamente fundamentadas, que
se originen o conozcan, que afecten la eficacia del
plaguicida autorizado o su seguridad en el uso, tanto desde
el punto de vista toxicológico como ecotoxicológico,
ambiental, de residuos, de metodología analítica y/o
envases. En caso de que el titular no presente los
antecedentes correspondientes, el Servicio podrá suspender
la autorización hasta que se presente, evalúe y se
resuelva, cuando los motivos técnicos así lo ameriten.
Para esto, el titular deberá adjuntar el Resumen Ejecutivo
actualizado y los antecedentes técnicos de metodología
analítica, residuos, seguridad, toxicología, medio
ambiente, ecotoxicología y/o envases, según corresponda.
El Servicio evaluará los antecedentes, y tomará las
medidas correspondientes, como la inclusión de los nuevos
antecedentes en el expediente, restricciones en el uso, o la
cancelación de la autorización, u otras de acuerdo al
caso. En caso que se requiera, la modificación de algún
aspecto de la etiqueta, el titular tendrá que solicitarlo
de acuerdo a los numerales 26.2 y 27.5.1.
Los plaguicidas autorizados de acuerdo a la resolución
antes indicada podrán solicitar su modificación, de
acuerdo a los requisitos establecidos en el numeral 27 de
esta resolución.
| NOTA
La letra g), 1.1 del N° 1 de la Resolución 1208
Exenta, Agricultura, publicada el 11 de marzo de 2016,
modifica el numeral 2 de la presente norma en el sentido de
suprimir de la tabla de acrónimos, la fila: HDST: | Hoja de
Datos de Seguridad de Transporte. | |
|
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.1, a) y b)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.1, c)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° N° 4; 1., a. y b.
D.O. 10.11.2023 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 1., c. y d.
D.O. 10.11.2023 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.1, f)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 1., e.
D.O. 10.11.2023 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.2, a)
D.O. 11.03.2016 |
| Resolución 7128 EXENTA,
AGRICULTURA
N° 1, 1.1
D.O. 14.12.2022 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 2.
D.O. 10.11.2023 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.3, b)
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.4, a) i) y ii)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.4, b) i) y ii)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.5
D.O. 11.03.2016 |
| Resolución 14 EXENTA,
AGRICULTURA
N° 1, 1.1
D.O. 21.01.2019 |
| Resolución 7128 EXENTA,
AGRICULTURA
N° 1, 1.2
D.O. 14.12.2022 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 a)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 3.
D.O. 10.11.2023 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 a)
D.O. 06.10.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 b)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 b)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 c)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 c)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 d)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 e) i)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 e) ii)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 d)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 f)
D.O. 11.03.2016 |
| Resolución 5482
EXENTA,
AGRICULTURA
N° 1 e)
D.O. 06.10.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.6 g)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 f)
D.O. 06.10.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 g)
D.O. 06.10.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.6 h)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 i)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 h)
D.O. 06.10.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N°1 i)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.6 l)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.7 a)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 4.
D.O. 10.11.2023 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.7 b)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.7 c)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 j)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.7 d) i) y ii)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.7 e)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 k)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.7 i)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 l)
D.O. 06.10.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.7 j)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.7 k)
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.7 l)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 m)
D.O. 06.10.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.7 m)
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.8 y 1.9
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.10
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.11
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.12 a)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 n)
D.O. 06.10.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 ñ)
D.O. 06.10.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 o)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.12 b)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.12 c)
D.O. 11.03.2016 |
| Resolución 14 EXENTA,
AGRICULTURA
N° 1, 1.2
D.O. 21.01.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.13
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.14 a)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 5.
D.O. 10.11.2023 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 p)
D.O. 06.10.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.14 b)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 q)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.14 c)
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 r)
D.O. 06.10.2016 |
| Resolución 5482
EXENTA,
AGRICULTURA
N° 1 t)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.14 d)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.10
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.15
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.16
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.17
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.18
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.19
D.O. 11.03.2016 |
| Resolución 7128 EXENTA,
AGRICULTURA
N° 1, 1.3
D.O. 14.12.2022 |
| Resolución
1208 EXENTA,
AGRICULTURA
N° 1, 1.10
D.O. 11.03.2016 |
| Resolución 14 EXENTA,
AGRICULTURA
N° 1, 1.3
D.O. 21.01.2019 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.10
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.20
D.O. 11.03.2016 |
| Resolución 14 EXENTA,
AGRICULTURA
N° 1, 1.4
D.O. 21.01.2019 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.21 i)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.21 ii)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 a) i)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 a) ii)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 a) iii)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 a)
iv), v) y vi)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 b)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 c)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 d)
D.O. 11.03.2016 |
| Resolución
1208 EXENTA,
AGRICULTURA
N° 1, 1.22 e)
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.22 f)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 g)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 h)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 6., a.
D.O. 10.11.2023 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 i)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 6., b.
D.O. 10.11.2023 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.22 j)
D.O. 11.03.2016 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 6., c.
D.O. 10.11.2023 |
| Resolución 6152 EXENTA,
AGRICULTURA
N° 4; 6., d.
D.O. 10.11.2023 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.23
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 u)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.24
D.O. 11.03.2016 |
| Resolución 5482 EXENTA,
AGRICULTURA
N° 1 v)
D.O. 06.10.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.25 a)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.25 b)
D.O. 11.03.2016 |
| Resolución 1208 EXENTA,
AGRICULTURA
N° 1, 1.10
D.O. 11.03.2016 |
| Resolución 1208
EXENTA,
AGRICULTURA
N° 1, 1.26
D.O. 11.03.2016 |
| Resolución 14 EXENTA,
AGRICULTURA
N° 1, 1.5
D.O. 21.01.2019 |
|

